
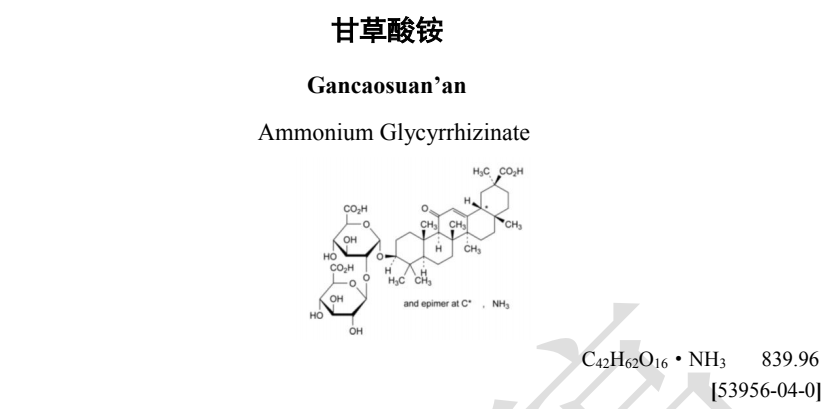
本品為 18α-甘草酸銨和 18β-甘草酸銨的混合物,主要成分為(20β)-3β-[2-O-(β-D -吡喃葡萄糖醛酸基)-α-D -吡喃葡萄糖醛酸基] 氧基-11-氧代齊墩果-12-烯-29-酸的銨鹽。以無水與無乙醇物計算,含 C42H62O16·NH3 應為 78.0%~102.0%,其中含 18α-甘草酸銨不得過13.0%。
【性狀】 本品為白色至淺黃色粉末或顆粒。比旋度 取本品約 0.5g,精密稱定,置 50ml 量瓶中,加 50%乙醇溶解并稀釋至刻度,搖勻。在 25℃時,依法測定(通則 0621),按無水無乙醇物計算,比旋度應為+49.0°至+55.0°。
【鑒別】
(1)取本品約 0.2g 于 10ml 試管中,加入 1mol/L 氫氧化鈉溶液 1ml,振搖,產生的氣
體能使濕潤的紅色石蕊試紙變藍色。
(2)在含量測定項下記錄的色譜圖中,供試品溶液中 18α-甘草酸和 18β-甘草酸峰的保
留時間分別與系統適用性溶液中相應峰的保留時間一致。
(3)取本品適量,平鋪于稱量瓶中(厚度約 1mm),置溫度為 25℃,相對濕度約為90%的條件下放置 24 小時后,置溫度為 25℃,相對濕度約為 20%的條件下再放置 24 小時,
依法測定(通則 0402)。本品的紅外光吸收圖譜應與甘草酸銨對照品(必要時與供試品同
法處理)的圖譜一致。
【檢查】溶液的澄清度與顏色 取本品約0.1g,加 20%乙醇20ml溶解并稀釋至100ml,
溶液應澄清無色;如顯色,與橙黃色 0.5 號標準比色液(通則 0901 第一法)比較,不得更深。
有關物質 照高效液相色譜法(通則 0512)測定。取本品適量,精密稱定,加流動相溶解并定量稀釋制成每 1ml 約含甘草酸銨 1mg 的溶液,作為供試品溶液。精密量取供試品溶液適量,加流動相稀釋制成每 1ml 含甘草酸銨 0.05mg 的溶液,作為對照溶液。系統適用性溶液、色譜條件、系統適用性要求見含量測定項下。精密量取供試品溶液與對照溶液各 10ul,分別注入液相色譜儀,記錄色譜圖至主峰保留時間的 3 倍。供試品溶液色譜圖中如有與雜質 I(相對保留時間約 0.7)保留時間一致的色譜峰,雜質 I 不得大于對照溶液除溶劑峰外各色譜峰面積之和的 1.14 倍(5.7%);其他單個雜質不得大于對照溶液除溶劑峰外各色譜峰面積之和的 0.4 倍(2.0%);其他各雜質峰面積的和不得大于對照溶液除溶劑峰外各色譜峰面積之和的 1.6 倍(8.0%)。
乙醇 取本品約 0.1g,精密稱定,置頂空瓶中,精密加入 0.1mol/L 氫氧化鈉溶液 5ml 使溶解,密封,作為供試品溶液。另取乙醇對照品適量,精密稱定,用 0.1mol/L 氫氧化鈉溶液溶解并定量稀釋制成每 1ml約含乙醇 1mg 的溶液,精密量取 5ml,置頂空瓶中,密封,作為對照品溶液。照氣相色譜法(通則 0521)試驗,用 6%氰丙基苯基-94%二甲基聚硅氧烷(或極性相近)為固定液的毛細管柱;起始溫度為 40℃,維持 1 分鐘,以每分鐘 15℃的速率升溫至 200℃,維持 5 分鐘;進樣口溫度為 220℃;檢測器溫度為 250℃;頂空瓶平衡溫度為 90℃,平衡時間為 30 分鐘。
取供試品溶液與對照品溶液分別頂空進樣,記錄色譜圖。按外標法以峰面積計算,即得。水分 取本品,照水分測定法(通則 0832 第一法 1)測定,含水分不得過 6.0%。熾灼殘渣 取本品 1.0g,依法檢查(通則 0841),遺留殘渣不得過 0.5%。
【含量測定】照高效液相色譜法(通則 0512)測定。用十八烷基硅烷鍵合硅膠為填充劑;以乙腈-冰醋酸-水(38:1:61)為流動相,檢測波長為 254nm。取甘草酸銨對照品(含 18α-甘草酸銨和 18β-甘草酸銨)適量,加流動相溶解并稀釋制成每 1ml 約含 1mg 甘草酸銨的溶液,作為系統適用性溶液。量取 10ul 注入液相色譜儀,記錄色譜圖,18α-甘草酸銨和 18β-甘草酸銨(相對保留時間分別約為 1.5 和 1.0)的分離度應不低于 2.0。取本品適量,精密稱定,用流動相溶解并定量稀釋制成每 1ml 中約含 0.5mg 甘草酸銨的溶液,作為供試品溶液,精密量取 10ul 注入液相色譜儀,記錄色譜圖。另取 18β-甘草酸對照品適量,用流動相溶解并定量稀釋制成每 1ml 中約含 0.5mg 18β甘草酸的溶液,作為對照品溶液,同法測定。按外標法以峰面積分別計算 18α-甘草酸銨和 18β-甘草酸銨的含量,將結果乘以 1.02,并計算總和,即得。
【類別】 甜味劑。
【貯藏】 密封保存。
【標示】 應標明乙醇含量。
注:①本品有引濕性。②為滿足制劑穩定性和安全性要求,必要時可對元素雜質鉛進行
控制。2025 年 1 月
起草單位:廣東省藥品檢驗所 聯系電話:020-81853846
復核單位:武漢藥品醫療器械檢驗所
甘草酸銨藥用輔料標準草案修訂說明
1.名稱 根據征集樣品的實際情況,并結合國外藥典規定擬定。
2.性狀 根據征集樣品的實際情況,并結合國外藥典規定擬定。
3.鑒別 采用理化、液相和紅外鑒別方法進行鑒別,根據征集樣品實際情況并結合國藥藥典規定擬定。
4.檢查
4.1溶液的澄清度與顏色 參考國外藥典并結合中國藥典通則《0901溶液顏色檢查法》擬定。
4.2 有關物質 由于甘草酸皂苷 G2(24-羥基-甘草酸)存在于甘草原料中,在目前主流的甘草酸銨中提取工藝中難以完全去除。對 24-羥基-甘草酸進行控制具有必要性。參考國外藥典擬定。
4.3 乙醇 由于本品的主要工藝為乙醇浸提,且乙醇與甘草酸銨可能形成溶劑化結晶,乙醇的去除需要特定工藝,故有必要對本品乙醇含量進行考察。鑒于本品主要作為甜味劑,在使用過程中添加量較少,乙醇為 3 類溶劑,根據中國藥典與 ICHQ3C 協調的相關原則,在標準中不進行限度控制,但由于此項目結果需用于含量計算,故需在標示項下標示。
4.4 水分 由于本品具有引濕性,如果未能妥善保管可能會導致水分吸收,影響樣品純度和質量穩定性,對本品水分控制具有必要性。參考國外藥典擬定。
4.5 熾灼殘渣 根據征集樣品的實際情況,并結合國外藥典規定擬定。
5.含量測定:根據征集樣品的實際情況,并結合國外藥典規定擬定。
6.類別參考國藥藥典及《藥用輔料手冊》擬定。
7 貯藏由于本品具有引濕性,根據樣品情況及參考國外藥典,擬定密封保存。
8.標示由于乙醇測定結果需用于含量計算,故擬定在標示項下進行標示。
來源:藥典委
原文下載:![]() 甘草酸銨藥用輔料標準草案公示稿.pdf
甘草酸銨藥用輔料標準草案公示稿.pdf

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃