
0102 注射劑公示稿(第三次)(簡易版)
0102 注射劑系指原料藥物或與適宜的輔料制成的供注入體內的無菌制劑。注射劑可分為注射液、注射用無菌粉末與注射用濃溶液等。注射液 系指原料藥物或與適宜的輔料制成的供注入體內的無菌液體制劑,包括溶液型、乳狀液型和混懸型等注射液。可用于皮下注射、皮內注射、肌內注射、靜脈注射、靜脈滴注、鞘內注射或、椎管內注射等。其中,供靜脈滴注用的大容也可稱為輸液。中藥注射劑一般不宜制成混懸型注射液。乳狀液型注射液,不得用于椎管內注射。混懸型注射液不得用于靜脈注射或椎管內注射。
注射用無菌粉末 系指原料藥物或與適宜輔料制成的供臨用前用無菌溶液配制成注射液的無菌粉末或無菌塊狀物,臨用前可用適宜的注射用溶劑配制后注射,也可用靜脈輸液配制后靜脈滴注。以冷凍干燥法制備的注射用無菌粉末,也可稱為注射用凍干制劑。注射用無菌粉末配制成注射液后應符合注射劑的要求。
注射用濃溶液 系指原料藥物與適宜輔料制成的供臨用前稀釋后注射的無菌濃溶液。注射用濃溶液稀釋后應符合注射劑的要求。注射劑在生產與貯藏期間應符合下列規定。
一、注射劑所用的原輔料應從來源及生產工藝等環節進行嚴格控制并應符合注射用的質量要求。除另有規定外,制備中藥注射劑的飲片等原料藥物應嚴格按各品種項下規定的方法提取、純化,制成半成品、成品,并應進行相應的質量控制。生物制品原液、半成品和成品的生產及質量控制應符合相關品種要求。
二、注射劑所用溶劑應安全無害,并與其他藥用成分兼容性良好,不得影響活性成分的療效和質量。一般分為水性溶劑和非水性溶劑。
(1)水性溶劑最常用的為注射用水,也可用 0.9%氯化鈉溶液或其他適宜的水溶液。
(2)非水性溶劑常用的為植物油,主要為供注射用的大豆油,其他還有乙醇、丙二醇和聚乙二醇等。供注射用的非水性溶劑,應嚴格限制其用量,并應符合質量標準在各品種項下進行相應的檢查。
三、配制注射劑時,可根據需要加入適宜的附加劑,如滲透壓調節劑、pH 值調節劑、增溶劑、助溶劑、抗氧劑、抑菌劑、乳化劑、助懸劑等。附加劑的選擇應考慮到對藥物療效和安全性的影響,使用濃度不得引起毒性或明顯的刺激,且避免對檢驗產生干擾。常用的抗氧劑有亞硫酸鈉、亞硫酸氫鈉和焦亞硫酸鈉等,一般濃度為 0.1%~0.2%。多劑量包裝的注射液可加適宜的抑菌劑,抑菌劑的用量應能抑制注射液中微生物的生長,。除另有規定外,注射劑在確定處方時,應評估和考察加入抑菌劑的必要性、抑菌劑的類型和加入量;,若加入抑菌劑,在制劑確定處方時,該處方的抑菌效力應符合抑菌效力檢查法(通則 1121)的規定。加有抑菌劑的注射液,仍應采用適宜的方法滅菌。靜脈給藥與腦池內、硬膜外、椎管內用的注射液均不得加抑菌劑。常用的抑菌劑為 0.5%苯酚、0.3%甲酚、0.5%三氯叔丁醇、0.01%硫柳汞等。
四、注射液一般是原料藥和適宜輔料經配制、過濾、灌封、滅菌等工藝步驟制備而成。難溶性藥物可采用增溶、乳化或粉碎等工藝制備成溶液型、乳狀液型或混懸型注射液;注射用無菌粉末一般采用無菌分裝或冷凍干燥法制得;注射用濃溶液的制備方法與溶液型注射液類似。
在注射劑的生產過程中應盡可能縮短配制時間,防止微生物與熱原的污染及原料藥物變質。輸液的配制過程更應嚴格控制。制備混懸型注射液和乳狀液型注射液的過程中,要采取必要的措施,保證粒子大小符合質量標準的要求。注射用無菌粉末應按無菌操作制備。必要時注射劑應進行相應的安全性檢查,如異常毒性、過敏反應、溶血與凝聚、降壓物質等,均應符合要求。
五、注射劑的灌裝標示裝量不大于 50ml 時,可參考下表適當增加裝量。;大于 50ml 時,需根據各品種特性評估并確定增加量。除另有規定外,多劑量包裝的注射劑,每一容器的裝量一般不得超過 10 次注射量,增加的裝量應能保證每次注射用量。
注射劑灌裝后應盡快熔封或嚴封。接觸空氣易變質的原料藥物,在灌裝過程中應排除容器內的空氣,可填充二氧化碳或氮等氣體,立即熔封或嚴封。對溫度敏感的原料藥物在灌封過程中應控制溫度、時間等,灌封完成后應及時立即將注射劑置于規定的溫度下貯存。制備注射用凍干制劑時,分裝后應及時冷凍干燥。凍干后殘留水分應符合相關品種的要求。生物制品的分裝和凍干,還應符合“生物制品分裝和凍干規程”的要求。
六、注射劑熔封或嚴封后,一般應根據原料藥物性質選用適宜的方法進行滅菌,必須保證制成品無菌。注射劑應采用適宜方法進行容器檢漏。
七、溶液型注射液應澄清;除另有規定外,混懸型注射液中原料藥物粒徑應控制在 15μm 以下,含 15~20μm(間有個別 20~50μm)者,不應超過 10%,若有可見沉淀,振搖時應容易分散均勻。乳狀液型注射液,不得有相分離現象;靜脈用乳狀液型注射液中 90%的乳滴粒徑應在 1μm 以下,除另有規定外,不得有大于 5μm 的乳滴。除另有規定外,輸液應盡可能與血液等滲。
八、注射劑常用容器有玻璃安瓿、玻璃瓶、塑料安瓿、塑料瓶(袋)、預裝式注射器等。容器的密封性,須用適宜的方法確證。除另有規定外,容器應符合有關注射用玻璃容器和塑料容器的國家標準規定。容器用膠塞特別是多劑量包裝注射液用的膠塞要有足夠的彈性和穩定性,其質量應符合有關國家標準規定。除另有規定外,容器應足夠透明,以便內容物的檢視。
九、除另有規定外,注射劑應避光貯存。生物制品原液、半成品和成品的生產及質量控制應符合相關品種要求。
十、注射劑的標簽或說明書中應標明其中所用輔料的名稱,如有抑菌劑還應標明抑菌劑的種類及濃度;注射用無菌粉末應標明配制溶液所用的溶劑種類,必要時還應標注溶劑量。除另有規定外,注射劑應進行以下相應檢查。
【裝量】注射液和及注射用濃溶液照下述方法檢查,應符合規定。檢查法 單劑量供試品:標示裝量不大小于等于32ml者,取供試品5支(瓶);2 大于 3ml 以上至不大小于 510ml 者,取供試品 3 支(瓶);。大于等于 10ml 以上至小于等于 50ml 者,取供試品 1 支(瓶)。開啟時注意避免損失,將內容物分別用相應體積的干燥注射器(體積不大于供試品體積的 3 倍)及 21G 注射針頭(不短于 2.5cm)抽盡,排盡氣泡,然后緩慢連續地注入經標化的量入式量筒內(量筒的大小應使待測體積至少占量筒其額定體積的 40%,不排盡針頭中的液體),在室溫下檢視。測定油溶液、乳狀液或混懸液和粘稠溶液時,應必要時可先加溫(如有必要),充分振搖勻,再用干燥注射器及注射針頭抽盡后,同前法操作,如加溫,應加溫時放至 20-25℃冷(加溫時),檢視。大于等于 10 ml 者,也可開啟后直接緩慢傾出供試品至量入式量筒中檢視。每支(瓶)的裝量均不得少于其標示裝量。
也可采用重量除以密度計算裝量:準確量取供試品,精密稱定,求出每 1ml供試品的重量(即供試品的密度)。測定乳狀液和混懸液的密度時應先搖勻。用干燥注射器及注射針頭抽出(大于等于 10 mL 者可直接緩慢傾出供試品內容物,至已知重量的燒杯中),精密稱定內容物重量,再除以供試品密度,得出相應的裝量。生物制品多劑量供試品:取供試品 1 支(瓶),按標示的劑量數和每劑的裝量,分別用注射器及注射針頭抽出,按上述步驟測定單次劑量,每劑均應不得低于標示裝劑量。標示裝量為 50ml 以上的注射液及注射用濃溶液照最低裝量檢查法(通則0942)檢查,應符合規定。標示裝量為 50ml 以上的大容量供試品:取供試品 1支(瓶),開啟時注意避免損失,將內容物轉移至經標化的干燥量入式量筒中(使待測體積至少占量筒額定體積的 40%)。其 1 支(瓶)的裝量應不得少于其標示裝量。也可采用重量除以相對密度計算裝量。準確量取供試品,精密稱定,求出每1ml 供試品的重量(即供試品的相對密度);精密稱定用干燥注射器及注射針頭抽出或直接緩慢傾出供試品內容物的重量,再除以供試品相對密度,得出相應的裝量。
預裝式注射器和彈筒式裝置的供試品:除另有規定外,標示裝量小于等于不大于 23ml 者,取供試品 5 支(瓶);大于 23ml 以上至不大小于 510ml 者,取供試品 3 支(瓶);大于等于 10ml 以上至小于等于 50ml 者,取供試品 1 支(瓶)。供試品與所配注射器、針頭或活塞裝配后,將供試品緩慢連續注入干燥容器(不排盡針頭中的液體),按單劑量供試品要求進行裝量檢查,每只(瓶)的裝量均不得少于其標示裝量應不低于標示裝量。也可采用重量除以密度計算裝量:準確量取供試品,精密稱定,求出每 1ml供試品的重量(即供試品的密度)。測定乳狀液和混懸液的密度時應先搖勻。用干燥注射器及注射針頭抽出(大于等于 10ml 者可直接緩慢傾出供試品內容物,至已知重量的燒杯中),精密稱定內容物重量,再除以供試品密度,得出相應的裝量。
也可采用重量除以密度計算裝量:準確量取供試品,精密稱定,求出每 1ml供試品的重量(即供試品的密度)。測定乳狀液和混懸液的密度時應先搖勻。精密稱定用干燥注射器及注射針頭抽出或直接緩慢傾出供試品內容物,精密稱定內容物的重量,再除以供試品密度,得出相應的裝量。
【裝量差異】 除另有規定外,注射用無菌粉末照下述方法檢查,應符合規定。
檢查法 取供試品 5 支瓶(支瓶),除去標簽、鋁蓋,容器外壁用乙醇擦凈,干燥,開啟時注意避免玻璃屑等異物落入容器中,分別迅速精密稱定;容器為玻璃瓶的注射用無菌粉末,首先小心開啟內塞,使容器內外氣壓平衡,蓋緊后精密稱重。然后傾出內容物,容器用水或乙醇洗凈,在適宜條件下干燥后,再分別精密稱定每一容器的重量,求出每支瓶(支瓶)的裝量與平均裝量。每瓶支(支瓶)裝量與平均裝量相比較(如有標示裝量,則與標示裝量相比較),應符合下列規定,如有 1 瓶支(支瓶)不符合規定,應另取 10 瓶支(支瓶)復試,應符合規定。
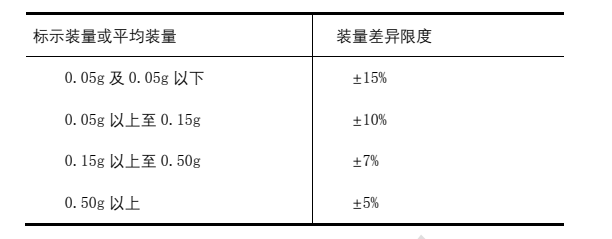
凡規定檢查含量均勻度的注射用無菌粉末,一般不再進行裝量差異檢查。
【滲透壓摩爾濃度】 除另有規定外,靜脈輸液及椎管注射用注射液按各品種項下的規定,照滲透壓摩爾濃度測定法(通則 0632)檢查,應符合規定。
【可見異物】 除另有規定外,照可見異物檢查法(通則 0904)檢查,應符合規定。
【不溶性微粒】 除另有規定外,用于靜脈注射、靜脈滴注、鞘內注射、椎管內注射的溶液型注射液、注射用無菌粉末及注射用濃溶液照不溶性微粒檢查法(通則 0903)檢查,均應符合規定。
【中藥注射劑有關物質】 按各品種項下規定,照注射劑有關物質檢查法(通則 2400)檢查,應符合有關規定。
【重金屬及有害元素殘留量】 除另有規定外,中藥注射劑照鉛、鎘、砷、汞、銅測定法(通則 2321)測定,按各品種項下每日最大使用量計算,鉛不得超過 12μg,鎘不得超過 3μg,砷不得超過 6μg,汞不得超過 2μg,銅不得超過150μg。
【無菌】 照無菌檢查法(通則 1101)檢查,應符合規定。
【細菌內毒素】或【熱原】 除另有規定外,靜脈用注射劑按各品種項下的規定,照細菌內毒素檢查法(通則 1143)或熱原檢查法(通則 1142)檢查,應符合規定。
起草單位: 北京大學、中國食品藥品檢定研究院、中國藥科大學
聯系電話: 010-67079578
2024 年 8 月
第三次公示稿修改處加灰底色標記
附件 2:0102 注射劑公示稿(第三次)修訂說明
0102 注射劑公示稿(第三次)修訂說明
根據第二次公示反饋意見和建議,進行以下修訂:
1. 為避免歧義,調整或增加生產與貯藏項下部分文字。
2. 調整并優化檢查項下相關描述。
來源:CDE
原文下載:![]() 0102 注射劑(第三次公示).pdf
0102 注射劑(第三次公示).pdf

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃