
注射劑的過量灌裝是指每個容器中藥品的灌裝量較標示量適當增加的體積或重量,以確保實際給藥劑量滿足說明書中規(guī)定的用量。為完善化學仿制藥注射劑過量灌裝的藥學研究和申報資料要求,結合國內(nèi)外仿制藥研發(fā)與生產(chǎn)現(xiàn)狀,
制定本指導原則。本指導原則僅適用于采用安瓿瓶和西林瓶包裝的化學仿制藥注射劑上市申請和上市后相關變更研究(如,可能影響灌裝體積的變更等),不適用于其他包裝形式的注射劑(如,預灌封包裝系統(tǒng)、靜脈輸液袋等)。本指導原則僅代表藥品監(jiān)管部門對于該問題的當前認知,旨在為新申報的化學仿制藥注射劑上市申請和相關研究提供指導。隨著相關法規(guī)的不斷完善以及藥物研究技術要求的提高,本指導原則中的關內(nèi)容將不斷完善與更新。
鑒于包材粘附等原因,為了保證實際給藥劑量滿足說明書中規(guī)定的用量,應適當增加裝量。增加的裝量應能確保每支(瓶)產(chǎn)品的可轉(zhuǎn)移劑量均不低于標示量。同時,增加的裝量不應造成明顯的藥物過量而引起安全性方面的風險,以及給藥后藥瓶中殘留藥品過多可能用于第二劑而造成的藥品污染、錯用等風險。根據(jù)中國藥典通則,注射劑的灌裝標示裝量不大于50ml時,可參考中國藥典推薦的易流動液和粘稠液過量灌裝量,適當增加裝量。為確保仿制藥用法用量與參比制劑的一致性,化學仿制藥注射劑的過量灌裝宜與參比制劑保持一致,如不一致需提供合理性論證,應確保每支(瓶)產(chǎn)品的實際給藥劑量均不低于標示量。
申請人應充分調(diào)研參比制劑信息,包括相關專利、文獻、公開的審評報告、說明書等,并對多批參比制劑進行詳細研究,綜合分析參比制劑的過量灌裝情況。
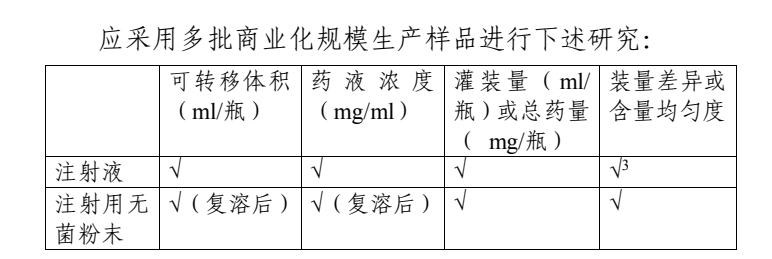
化學仿制藥注射液的濃度應與參比制劑標示濃度保持一致。為保證每支(瓶)產(chǎn)品均能轉(zhuǎn)移并使用標示的給藥劑量,可參考中國藥典適當增加灌裝量1。
申請人可按下式計算灌裝量范圍:
灌裝量下限=標示裝量+過量體積(ml)
灌裝量上限=標示裝量×合理論證的系數(shù)+過量體積(ml)
申請人在確定灌裝量上限時,應對系數(shù)進行合理論證,
可能的考慮因素包括但不限于灌裝精度、產(chǎn)品特點等(下同)。
注射用無菌粉末在臨用前需用適宜的溶劑配制后使用,應確保每瓶產(chǎn)品的實際給藥劑量均不低于標示量。根據(jù)參比制劑說明書中用法,其過量灌裝研究可分為以下兩種情形。參比制劑說明書中明確復溶后濃度的情形:根據(jù)參比制劑說明書的用法進行復溶后,仿制藥最低灌裝量的復溶后藥物濃度應與說明書中規(guī)定的復溶后藥物濃度一致。應對仿制藥復溶后藥液總體積進行研究2,按下式計算總藥量范圍:
總藥量下限=復溶后標示濃度(mg/ml)×復溶后總體積
總藥量上限=復溶后標示濃度(mg/ml)×合理論證的系數(shù)×復溶后總體積
參比制劑說明書中未明確復溶后濃度的情形:
根據(jù)參比制劑說明書的用法進行復溶后,仿制藥的可轉(zhuǎn)移劑量應滿足說明書標示的給藥劑量。
應對灌裝前藥液濃度、灌裝過程中灌裝量范圍進行合理控制,提供控制范圍制訂依據(jù)。
四、申報資料要求
申請人應在申報資料中提供過量灌裝的相關研究資料。過量灌裝量應在 CTD 通用技術文檔“3.2.P.1 劑型及產(chǎn)品組成”部分進行描述;相關研究驗證資料(如,可轉(zhuǎn)移體積測試、黏度研究、灌裝量范圍等)和過程控制應在 CTD 通用技術文檔“3.2.P.2 產(chǎn)品開發(fā)、3.2.P.3 生產(chǎn)”部分進行描述。
五、說明書和標簽
如適用,建議參照參比制劑說明書,在【用法用量】項下標注復溶后藥液濃度。為避免臨床用藥困惑,過量灌裝量通常不需要在標簽和說明書中特別說明。
六、名詞解釋
可轉(zhuǎn)移體積:系指根據(jù)中國藥典規(guī)定的【裝量】檢查方法或其他適宜且經(jīng)過驗證的方法,液體藥物或固體藥物復溶后可以從原容器中轉(zhuǎn)移的體積。
可轉(zhuǎn)移劑量:系指根據(jù)可轉(zhuǎn)移體積和藥物濃度(注射液)/復溶后藥物濃度(注射用無菌粉末)計算得到的活性成分的量。
灌裝量:系指西林瓶或安瓿瓶中注射液的液體總量(如,ml),包括標示裝量和增加的體積。
總藥量:系指西林瓶中的注射用無菌粉末中活性成分的總量(如,mg),包括標示裝量和增加的藥量。
標示量: 系指說明書和標簽中標示的活性成分的量。
七、參考文獻
1.中國藥典 2020 年版四部通則 0102
2.國家藥品監(jiān)督管理局. 化學藥品注射劑仿制藥質(zhì)量和療效一致性評價技術要求. 2020
3. FDA. Guidance for Industry:Allowable Excess Volumeand Labeled Vial Fill Size in Injectable Drug and Biological
Products.2015
4.FDA. Allowable Excess Volume/Content in InjectableDrug and Biological Products(MAPP 5019.1 Rev 1).2022
5.ICH Steering Committee, Harmonised Tripartite
來源:CDE

 冀公網(wǎng)安備 13010802000997號
冀公網(wǎng)安備 13010802000997號 微信掃一掃
微信掃一掃