
化藥口服固體制劑中間產(chǎn)品存放時(shí)限研究技術(shù)指導(dǎo)原則
一、概述
化藥口服固體制劑的中間產(chǎn)品質(zhì)量作為生產(chǎn)過程控制的關(guān)鍵部分,是藥品符合質(zhì)量標(biāo)準(zhǔn)的重要保證。該類制劑工藝通常包括多個(gè)生產(chǎn)工序,因生產(chǎn)安排等原因,可能導(dǎo)致中間產(chǎn)品無法及時(shí)進(jìn)行下一工序生產(chǎn)而需要暫存的情況,藥品注冊申請人/生產(chǎn)企業(yè)在研發(fā)及生產(chǎn)過程中應(yīng)關(guān)注中間產(chǎn)品的存放時(shí)限研究。存放時(shí)限是指中間產(chǎn)品在特定條件下存放并能維持其符合既定的質(zhì)量標(biāo)準(zhǔn)的時(shí)間長度。為進(jìn)一步加強(qiáng)國際人用藥品注冊技術(shù)協(xié)調(diào)會(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)質(zhì)量源于設(shè)計(jì)(Quality by Design,QbD)理念在實(shí)際生產(chǎn)中的運(yùn)用,提高化藥口服固體制劑生產(chǎn)過程中的風(fēng)險(xiǎn)控制水平,明確中間產(chǎn)品存放的相關(guān)技術(shù)要求,制定本指導(dǎo)原則。
本指導(dǎo)原則適用于化藥口服固體制劑,旨在解決制劑工業(yè)上關(guān)注的化藥口服固體制劑在非連續(xù)生產(chǎn)時(shí)不同生產(chǎn)工序中中間產(chǎn)品需要短暫存貯的問題,以期為藥物研發(fā)和生產(chǎn)過程中中間產(chǎn)品的存放時(shí)限研究提供技術(shù)指導(dǎo)和參考。通常情況,當(dāng)制劑整個(gè)生產(chǎn)過程超過 30 天時(shí),應(yīng)進(jìn)行中間產(chǎn)品存2放時(shí)限研究。當(dāng)制劑整個(gè)生產(chǎn)過程不超過 30 天時(shí),應(yīng)通過風(fēng)險(xiǎn)評估決定是否需要進(jìn)行中間產(chǎn)品存放時(shí)限研究。藥品注冊申請人/生產(chǎn)企業(yè)作為責(zé)任主體,應(yīng)結(jié)合產(chǎn)品和生產(chǎn)工藝的特點(diǎn),對可能影響中間產(chǎn)品質(zhì)量的因素如包裝形式、存放環(huán)境(溫度、濕度等)等進(jìn)行風(fēng)險(xiǎn)評估,設(shè)計(jì)合理的取樣計(jì)劃,選擇影響制劑生產(chǎn)及其關(guān)鍵質(zhì)量屬性的項(xiàng)目作為考察指標(biāo),提供支持性研究依據(jù)以證明存放時(shí)限的合理性。
本指導(dǎo)原則僅代表藥品監(jiān)管部門當(dāng)前的觀點(diǎn)和認(rèn)識,隨著科學(xué)研究的進(jìn)展,本指導(dǎo)原則中的相關(guān)內(nèi)容將不斷完善與更新。應(yīng)用本指導(dǎo)原則設(shè)計(jì)和實(shí)施研究時(shí),可同時(shí)參考藥品生產(chǎn)質(zhì)量管理規(guī)范(Good Manufacturing Practice,GMP)和其他國內(nèi)外相關(guān)的技術(shù)文件。
二、主要研究內(nèi)容
(一)樣品要求
中間產(chǎn)品的存放時(shí)限研究應(yīng)至少在中試規(guī)模批次中進(jìn)行,如果研究批量未達(dá)到商業(yè)化規(guī)模,則需承諾在商業(yè)化規(guī)模(涵蓋擬定的生產(chǎn)場地)中進(jìn)行確認(rèn)。當(dāng)產(chǎn)品處方、生產(chǎn)工藝、設(shè)備、貯藏條件和包材等發(fā)生變更時(shí),可通過風(fēng)險(xiǎn)評估來判定是否需要對存放時(shí)限進(jìn)行重新研究或再次確認(rèn)。至少選擇一批中間產(chǎn)品來確定存放時(shí)限,也可基于物料的特性和其他相關(guān)方面,通過風(fēng)險(xiǎn)評估來確定適當(dāng)?shù)呐巍?span style="font-size: 16px; font-family: Calibri;">3對于多規(guī)格制劑,可以基于風(fēng)險(xiǎn)評估選擇代表性的規(guī)格來進(jìn)行研究。
(二)研究對象、考察時(shí)間和考察項(xiàng)目
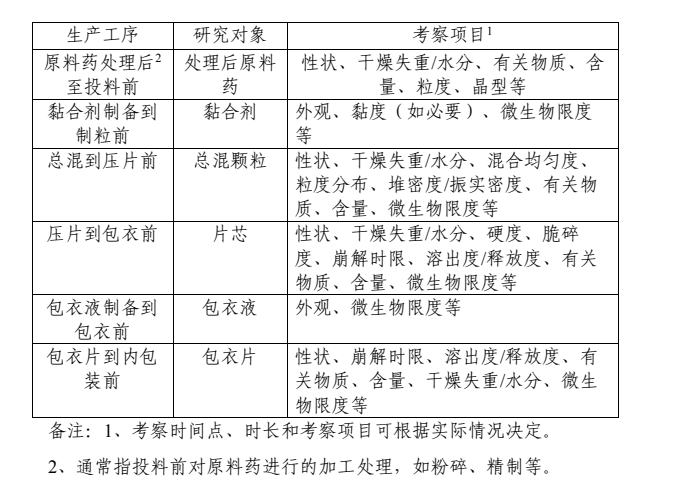
不同產(chǎn)品應(yīng)結(jié)合劑型、生產(chǎn)工藝的特點(diǎn),對生產(chǎn)過程進(jìn)行分析,根據(jù)需要特殊存貯和生產(chǎn)過程的時(shí)間,以及環(huán)境和存貯條件的潛在影響確定合理的研究對象。確定研究對象后,應(yīng)結(jié)合不同生產(chǎn)工序中中間產(chǎn)品的特性和存貯需求,并結(jié)合研究對象對后續(xù)工藝及制劑關(guān)鍵質(zhì)量屬性的影響,設(shè)定不同的考察時(shí)間點(diǎn)、時(shí)長和考察項(xiàng)目。考察項(xiàng)目應(yīng)能反映中間產(chǎn)品質(zhì)量的變化情況,即在放置過程中易發(fā)生變化的,可能影響成品質(zhì)量、安全性和/或有效性的項(xiàng)目,內(nèi)容通常涵蓋物理、化學(xué)和微生物學(xué)等特性。存放時(shí)限研究的持續(xù)時(shí)間應(yīng)該涵蓋擬定的最長存放時(shí)間,考察時(shí)間點(diǎn)應(yīng)至少包括開始、中間和結(jié)束時(shí)間。以口服包衣片劑為例,下表列舉了相關(guān)存放時(shí)限的生產(chǎn)工序、研究對象、考察項(xiàng)目(見示例)。本指導(dǎo)原則推薦的生產(chǎn)工序、研究對象及考察項(xiàng)目等并不包括所有生產(chǎn)情況,藥品注冊申請人/生產(chǎn)企業(yè)可根據(jù)劑型特點(diǎn)和生產(chǎn)需要并結(jié)合產(chǎn)品穩(wěn)定性情況,依據(jù)本指導(dǎo)原則研究思路并基于風(fēng)險(xiǎn)評估進(jìn)行選擇和調(diào)整。
示例 口服包衣片劑存放時(shí)限生產(chǎn)工序、研究對象、
考察項(xiàng)目4
(三)研究樣品的存放條件
存放條件不應(yīng)對后續(xù)的生產(chǎn)工藝以及中間產(chǎn)品的穩(wěn)定性、質(zhì)量、安全性和/或有效性產(chǎn)生不良影響。實(shí)際研究中建議制定存放時(shí)限的研究方案,研究樣品的存放條件應(yīng)考慮以下內(nèi)容:(1)樣品存放的環(huán)境條件應(yīng)與暫存區(qū)域的條件相當(dāng),否則應(yīng)說明其他條件的合理性;(2)樣品的暫存容器應(yīng)與商業(yè)化生產(chǎn)樣品暫存所用的容器相同,如果在存放時(shí)限考察中必須減小容器尺寸,應(yīng)使用等同的容器(材質(zhì)相同,使用與生產(chǎn)相同的密閉系統(tǒng)),并進(jìn)行合理性論證;(3)對于有穩(wěn)定性風(fēng)險(xiǎn)(如易氧化)的產(chǎn)品,暫存過程中應(yīng)關(guān)注中間產(chǎn)品的容器頂部空間對產(chǎn)品質(zhì)量的潛在影響,必要時(shí)存放時(shí)限研究應(yīng)考慮最差情形時(shí)的條件,頂部空間與存放容器容量的比例應(yīng)至少和常規(guī)生產(chǎn)中可能的最大情形相同(特別要考慮未裝滿容器)。如果存在跨場地轉(zhuǎn)移,還應(yīng)考慮轉(zhuǎn)移時(shí)間和轉(zhuǎn)移條件,必要時(shí)進(jìn)行加速試驗(yàn)以證明短期偏離存貯條件時(shí)的穩(wěn)定性。
(四)質(zhì)量標(biāo)準(zhǔn)與分析方法
根據(jù)產(chǎn)品特點(diǎn)和質(zhì)量控制需要合理設(shè)定中間產(chǎn)品存放時(shí)限研究的質(zhì)量標(biāo)準(zhǔn),所采用的分析方法應(yīng)經(jīng)過方法學(xué)驗(yàn)證并能滿足研究的要求。
(五)存放時(shí)限的確定
應(yīng)根據(jù)中間產(chǎn)品的穩(wěn)定性研究結(jié)果和實(shí)際生產(chǎn)需要擬定合理的存放時(shí)限。必要時(shí),應(yīng)將所獲得的數(shù)據(jù)進(jìn)行統(tǒng)計(jì)學(xué)研究,分析變化趨勢,以判定各考察項(xiàng)目擬定限度與存放時(shí)限設(shè)定的合理性。如果中間產(chǎn)品在存放時(shí)限研究期間內(nèi)的研究數(shù)據(jù)顯示有含量降低、降解產(chǎn)物增加等情形,則應(yīng)考慮對經(jīng)最長存放時(shí)限研究的中間產(chǎn)品制得的成品批次進(jìn)行加速/長期穩(wěn)定性試驗(yàn)或者考慮縮短中間產(chǎn)品的存放時(shí)限以確保生產(chǎn)出合格的制劑成品。
三、名詞解釋
中間產(chǎn)品:在生產(chǎn)過程中經(jīng)制備產(chǎn)生的物料,非最終產(chǎn)品。待包裝產(chǎn)品也視為中間產(chǎn)品。
四、參考文獻(xiàn)6
【1】WHO Technical Report Series,2015(992): Annex 4General guidance on hold-time studies.2015 年 10 月
【2】EMA Guideline on manufacture of the finished dosageform.2017 年
【3】藥品生產(chǎn)質(zhì)量管理規(guī)范.(2010 年修訂)
【4】藥品 GMP 指南(第 2 版). 國家藥品監(jiān)督管理局食品藥品審核查驗(yàn)中心.2023 年
【5】ICH Q8(R2)Pharmaceutical Development.2009 年 8月
【6】化學(xué)藥物(原料藥和制劑)穩(wěn)定性研究技術(shù)指導(dǎo)原則(修訂).2015 年 2 月
來源:CDE
原文下載:![]() 化藥口服固體制劑中間產(chǎn)品存放時(shí)限研究技術(shù)指導(dǎo)原則.pdf
化藥口服固體制劑中間產(chǎn)品存放時(shí)限研究技術(shù)指導(dǎo)原則.pdf

 冀公網(wǎng)安備 13010802000997號
冀公網(wǎng)安備 13010802000997號 微信掃一掃
微信掃一掃