
附件:9202 非無菌產(chǎn)品微生物限度檢查指導原則公示稿(第一次)
9202 非無菌產(chǎn)品微生物限度檢查指導原則
為更好應用非無菌產(chǎn)品微生物限度檢查:微生物計數(shù)法(通則 1105)、非無菌產(chǎn)品微生物限度檢查:控制菌檢查法(通則 1106)及非無菌藥產(chǎn)品微生物限度標準(通則 1107),特制定本指導原則。藥品中污染的某些微生物可能導致藥物活性降低, 甚至使藥品喪失療效,
從而對患者健康造成潛在的危害。因此,在藥品生產(chǎn)、貯藏和流通各個環(huán)節(jié)中,藥品生產(chǎn)企業(yè)應嚴格遵循 GMP 的要求指導原則,以降低產(chǎn)品受微生物污染程度。非無菌產(chǎn)品微生物計數(shù)法、控制菌檢查法及藥品微生物限度標準可用于判斷非無菌制劑及原料、輔料等是否符合藥典的規(guī)定,也可用于指導制劑、原料、輔料等的微生物檢驗質量標準的制定,及指導生產(chǎn)過程中間產(chǎn)品微生物質量的監(jiān)控。
本指導原則將對微生物限度檢查方法和標準中的特定內(nèi)容及應用做進一步的說明。
1. 非無菌藥產(chǎn)品微生物限度檢查過程中,如使用表面活性劑、滅活劑及中和劑,在確定其能否適用于所檢樣品及其用量時,除應證明該試劑對所檢樣品的處理有效外,還須確認該試劑不影響樣品中可能污染的微生物的檢出(即無毒性),因此無毒性確認試驗的菌株不能僅局限于驗證試驗菌株, 而應當包括產(chǎn)品中可能污染的微生物。
2. 供試液制備方法、抑菌成分的消除方法及需氧菌總數(shù)、霉菌和酵母菌總數(shù)計數(shù)方法應盡量選擇微生物計數(shù)方法中操作簡便、快速的方法,同時,所選用的方法應避免使用損失或損傷供試品中污染的微生物的方法。,如濾紙吸附、離心沉淀等供試品溶液前處理方法。當使用自然沉降法獲得上清液時,需考察沉降時間對微生物回收的影響,必要時可在方法中明確自然沉降時間。對于抑菌作用較強的供試品,在供試品溶液性狀允許的情況下,應盡量選用薄膜過濾法進行試驗。
3.對照培養(yǎng)基系指按培養(yǎng)基處方特別制備、質量優(yōu)良的培養(yǎng)基,用于培養(yǎng)基適用性檢查,以保證藥品微生物檢驗用培養(yǎng)基的質量。對照培養(yǎng)基一般由中國食品藥品檢定研究院研制及分發(fā),如需自行選擇對照培養(yǎng)基,應進行充分的風險評估,確保其符合檢查方法的要求及檢驗結果的一致性。
4. 進行微生物計數(shù)方法適用性試驗時,若因沒有適宜的方法消除供試品中的抑菌作用而導致微生物回收的失敗, 應采用能使微生物生長的更高稀釋級供試液進行方法適用性試驗。此時更高稀釋級供試液的確認要從低往高的稀釋級進行,最高稀釋級供試液的選擇根據(jù)供試品應符合的微生物限度標準和菌數(shù)報告規(guī)則而確定,如供試品應符合的微生物限度標準是 1g 需氧菌總數(shù)不得過 103cfu,那么最高稀釋級是 1∶10-3。 若采用允許的最高稀釋級供試液進行驗證試驗還存在 1 株或多株試驗菌的回收率達不到要求,那么應選擇回收情況最接近要求的方法進行供試品的檢測。如某種產(chǎn)品對某試驗菌有較強的抑菌性能,采用薄膜過濾法的回收率為 40%,而采用培養(yǎng)基稀釋法的回收率為 30%,那么應選擇薄膜過濾法進行該供試品的檢測。
在此情況下,生產(chǎn)單位或研制單位應根據(jù)原輔料的微生物質量、生產(chǎn)工藝及產(chǎn)品特性進行產(chǎn)品的風險評估, 以保證檢驗方法的可靠性, 從而保證產(chǎn)品質量。對于采用最高稀釋級計數(shù)的微生物計數(shù)方法,建議通過增加接種量(試驗平皿數(shù))來降低檢驗誤差,提高計數(shù)方法的準確度。
5. 控制菌檢查法沒有規(guī)定進一步確證疑似致病菌目標菌的方法。若供試品檢出疑似致病菌目標菌,確證的方法應選擇已被認可的菌種鑒定方法,如細菌鑒定一般依據(jù)《伯杰氏系統(tǒng)細菌學手冊》。對于供試品檢出控制菌或其他不可接受微生物時,應啟動微生物數(shù)據(jù)偏差(MDD)調查,一般包括實驗室調查和生產(chǎn)調查兩部分。實驗室調查可參考藥品微生物實驗室質量管理指導原則(指導原則 9203)的要求,包括樣品、人員、試劑耗材(包括培養(yǎng)基、稀釋液等)、實驗環(huán)境、設備設施、檢驗方法和操作等方面,以確定檢驗結果是否有效,進而報告檢驗結論。如確定檢出目標菌或其它不可接受微生物,生產(chǎn)單位應開展全面調查,包括人員、環(huán)境、設備設施、生產(chǎn)工藝過程、物料等方面,以確定污染的來源和超標發(fā)生的根本原因,并制定有效的糾正和預防措施。考慮到MDD 調查的時限性,可在實驗室調查完成之前啟動生產(chǎn)調查。
6. 藥品微生物檢查過程中, 如果藥典規(guī)定的微生物計數(shù)方法不能對微生物在規(guī)定限度標準的水平上進行有效的計數(shù),那么應選擇經(jīng)過驗證的、且檢測限盡可能接近其微生物限度標準的方法對樣品進行檢測。
7. 用于手術、燒傷及嚴重創(chuàng)傷的局部給藥制劑應符合無菌檢查法要求。對用于創(chuàng)傷程度難以判斷的局部給藥制劑,若沒有證據(jù)證明藥品不存在安全性風險,那么該藥品應符合無菌檢查法要求。
8.非無菌產(chǎn)藥品微生物限度標準中,藥用原料、輔料及中藥提取物僅規(guī)定檢查需氧菌總數(shù)、霉菌和酵母菌總數(shù),因此,在制定其微生物限度標準時,應根據(jù)原輔料的微生物污染特性、用途、相應制劑的生產(chǎn)工藝及特性等因素,還需控制具有潛在危害的致病菌不可接受的微生物。非無菌產(chǎn)品微生物限度標準中僅規(guī)定直接口服及泡服中藥飲片的微生物限度標準,但有些中藥飲片,如:外用的三七粉,還應根據(jù)微生物污染風險評估的結果,制定適宜的微生物限度標準。如藥品中含有極少量未經(jīng)提取的藥材原粉或礦物質(如人工牛黃中的牛膽粉為未經(jīng)提取的藥材原粉,1000g 小兒咽扁顆粒中僅含牛膽粉約 0.065g), 根據(jù)風險評估結果可考慮不按含有藥材原粉的限度標準執(zhí)行,同時可考慮不進行沙門菌的控制。
9.非無菌化學原輔料微生物限度的控制應基于風險評估,風險評估方法可以參考 ICH Q9《質量風險管理》推薦的風險評估和管理工具,或者其他合理的方法。風險評估需綜合考慮非無菌化學原輔料的性質(包括起始物料、溶劑、試劑、催化劑等)、生產(chǎn)工藝、生產(chǎn)環(huán)境、設備清潔狀態(tài)、人員素質、最差生產(chǎn)條件、歷史數(shù)據(jù)及趨勢等因素。在風險評估的基礎上,做出微生物是否能在原輔料中生長或存活、原輔料生產(chǎn)及處理步驟是否會減少微生物的初步判定,從而確定微生物限度檢查策略(定期抽檢或逐批檢查或可不考慮進行檢查)及相應的微生物限度標準。具體可參考圖 1 非無菌化學原輔料微生物限度檢查決策樹,制定其微生物限度控制策略。
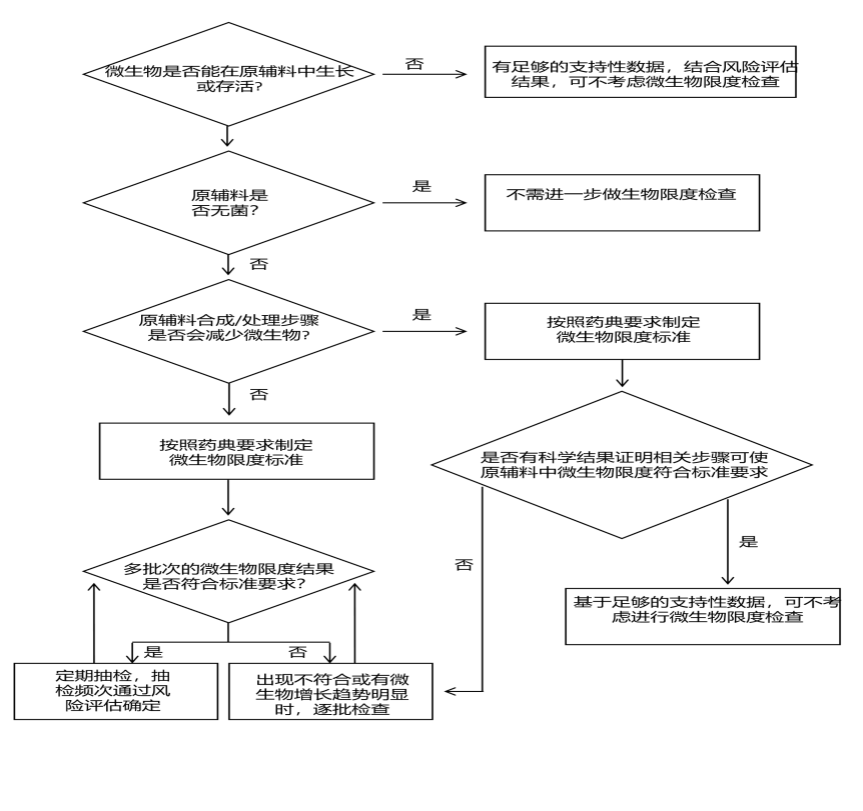
圖 1 非無菌化學原輔料微生物限度檢查決策樹
910. 對于《中國藥典》2020 年版制劑通則(通則 0100)項下有微生物限度要求的制劑,微生物限度為必檢項目;對于只有原則性要求的制劑(如部分化學藥品的:丸劑、口服片劑、膠囊劑、顆粒劑),應對其被微生物污染的風險進行評估。風險評估方法可以參考 ICH Q9《質量風險管理》推薦的風險評估和管理工具,或者其他合理的方法。風險評估需綜合考慮制劑特點、組成成份、生產(chǎn)工藝、生產(chǎn)環(huán)境、設備清潔狀態(tài)、人員素質、最差生產(chǎn)條件、歷史數(shù)據(jù)及趨勢等因素。在風險評估的基礎上,根據(jù)藥品制劑中是否含有抑菌劑或藥物本身是否具有抗微生物能力、是否為固體制劑及該固體制劑是否具有抑制微生物生長的特性,確定微生物限度檢查策略(定期抽檢或逐批檢查或可不考慮進行檢查)及相應的微生物限度標準。具體可參考圖 2 非無菌化學藥品制劑微生物限度檢查決策樹,制定其微生物限度控制策略。對于只有原則性要求的制劑,經(jīng)過評估,在保證產(chǎn)品對患者安全的前提下,通過回顧性驗證或在線驗證積累的微生物污染數(shù)據(jù),累積數(shù)據(jù)表明每批均符合微生物限度標準的要求,那么可
不進行批批檢驗,但必須保證每批最終產(chǎn)品均符合微生物限度標準規(guī)定。對于上述固體制劑若因制劑本身及工藝等的原因導致產(chǎn)品易受微生物污染的固體制劑,應在品種項下列出微生物限度檢查項及微生物限度標準。
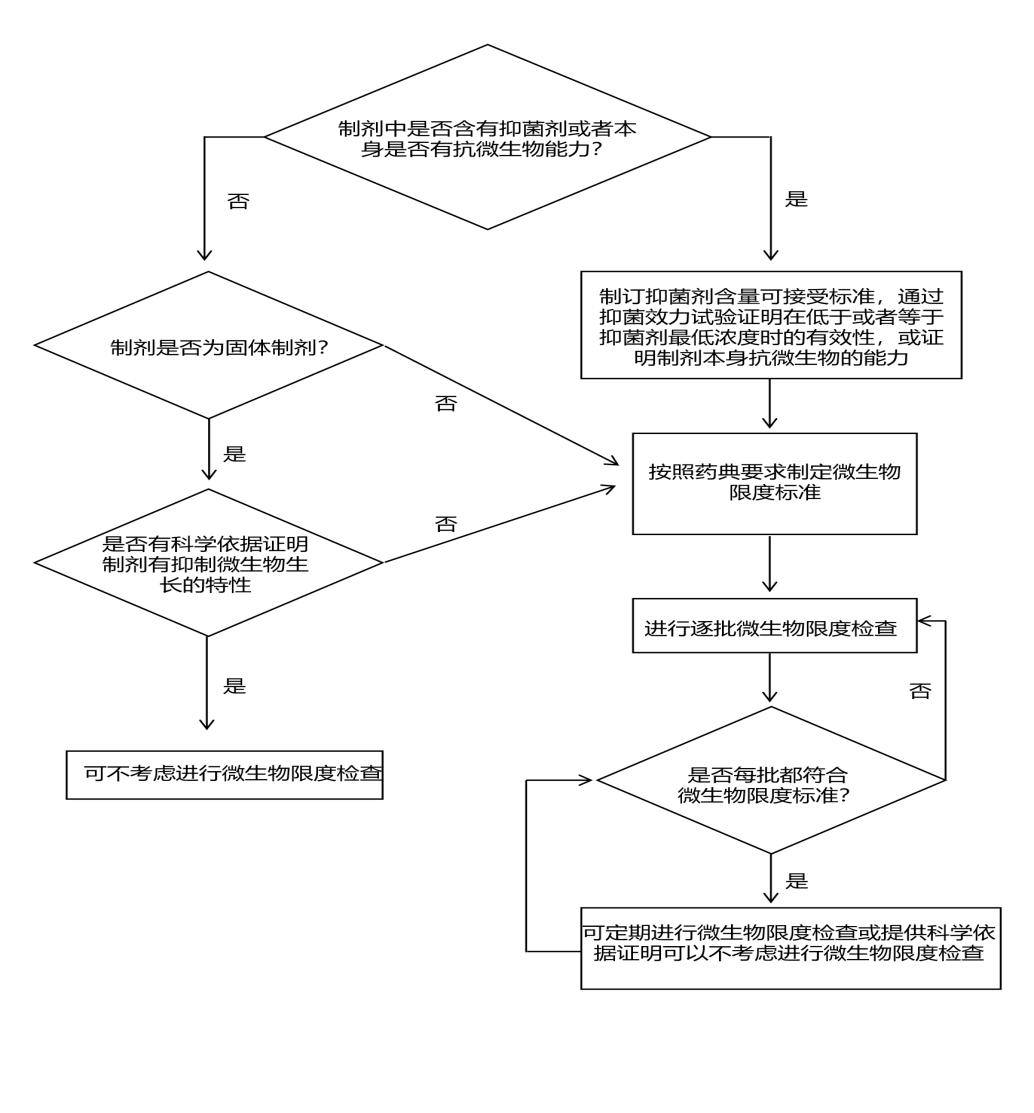
圖 2 非無菌化學藥品制劑微生物限度檢查決策樹
1011. 制定藥產(chǎn)品的微生物限度標準時,除了依據(jù)“非無菌藥產(chǎn)品微生物限度標準(通則 1107)”外,還應綜合考慮原料來源、性質、生產(chǎn)工藝條件、給藥途徑及微生物污染對患者的潛在危險等因素,提出合理安全的微生物限度標準,如特殊品種以最小包裝單位(如:以每貼或每罐或每瓶等)規(guī)定限度標準。必要時,某些藥品為保證其療效、穩(wěn)定性及避免對患者的潛在危害性, 應制定更嚴格的微生物限度標準,并在品種項下規(guī)定。
起草單位:遼寧省藥品檢驗檢測院 聯(lián)系電話:024-31266310
參與單位:中國食品藥品檢定研究院、天津市藥品檢驗研究院
9202 非無菌產(chǎn)品微生物限度檢查指導原則修訂說明
一、 制修訂的目的意義
9202 非無菌產(chǎn)品微生物限度檢查指導原則主要用于指導非無菌產(chǎn)品微生物限度檢查: 微生物計數(shù)法(通則 1105)、非無菌產(chǎn)品微生物限度檢查: 控制菌檢查法(通則 1106)及非無菌藥品微生物限度標準(通則 1107)。隨著微生物檢測技術的提升及我國微生物質量標準的提高,為更好指導微生物檢測工作,確保藥品微生物限度檢查的質量,針對供試品溶液制備遇到的難以固液分離、控制菌或其他致病菌檢出結果報告的調查和評估、標準限值和方法準確度、對照培養(yǎng)基等進行相應修訂。
二、 制修訂的總體思路
本次修訂充分參考、吸收國內(nèi)外藥品標準和制藥行業(yè)的反饋意見,針對通則 1105、1106、1107 修訂的內(nèi)容及執(zhí)行過程中遇到的常見問題,進行補充說明,并給出指導意見。
三、需說明的問題
本次修訂的主要內(nèi)容說明如下:
1. 關于供試液制備方法
明確了供試液制備方法時應避免使用濾紙吸附、離心沉淀等供試品溶液前處理方法。需要使用自然沉降法獲得上清液時,需考察沉降時間對微生物回收的影響。
2. 關于對照培養(yǎng)基
增加了如需自行選擇對照培養(yǎng)基,應進行充分的風險評估,確保其符合檢查方法的要求及檢驗結果的一致性。
3. 關于微生物計數(shù)方法和限值
對于采用最高稀釋級計數(shù)的微生物計數(shù)方法,建議通過增加接種量(試驗平皿數(shù))來降低檢驗誤差,提高計數(shù)方法的準確度。
4. 關于供試品檢出控制菌或其他不可接受微生物時的報告原則當供試品檢出控制菌或其他不可接受微生物時,實驗室應啟動微生物數(shù)據(jù)偏差(MDD)調查,經(jīng)充分的調查和評估以確定檢驗結果是否有效,進而報告檢驗結論。如確定檢出目標菌或其它不可接受微生物,生產(chǎn)單位應開展全面調查,以確定污染的來源和超標發(fā)生的根本原因,并制定有效的糾正和預防措施。
5. 關于藥品微生物限度標準
舉例說明,如外用的三七粉,應根據(jù)微生物污染風險評估的結果,制定適宜的微生物限度標準。對于藥品制劑中含有極少量未經(jīng)提取的藥材原粉或礦物質,根據(jù)風險評估結果可以考慮不按含有藥材原粉的限度標準執(zhí)行,同時可考慮不進行沙門菌的控制。
6. 參考 ICH Q6A,增加了非無菌化學藥品制劑及原輔料微生物限度風險評估及控制策略相關內(nèi)容。
來源:CDE
原文下載:
![]() 附件 9202 非無菌產(chǎn)品微生物限度檢查指導原則公示稿(第一次).pdf
附件 9202 非無菌產(chǎn)品微生物限度檢查指導原則公示稿(第一次).pdf

 冀公網(wǎng)安備 13010802000997號
冀公網(wǎng)安備 13010802000997號 微信掃一掃
微信掃一掃