
近日,國家藥監局(CDE)發布《中國新藥注冊臨床試驗進展年度報告(2021年)》,對2021年中國新藥注冊臨床試驗現狀及近三年的變化趨勢進行全面匯總和分析。
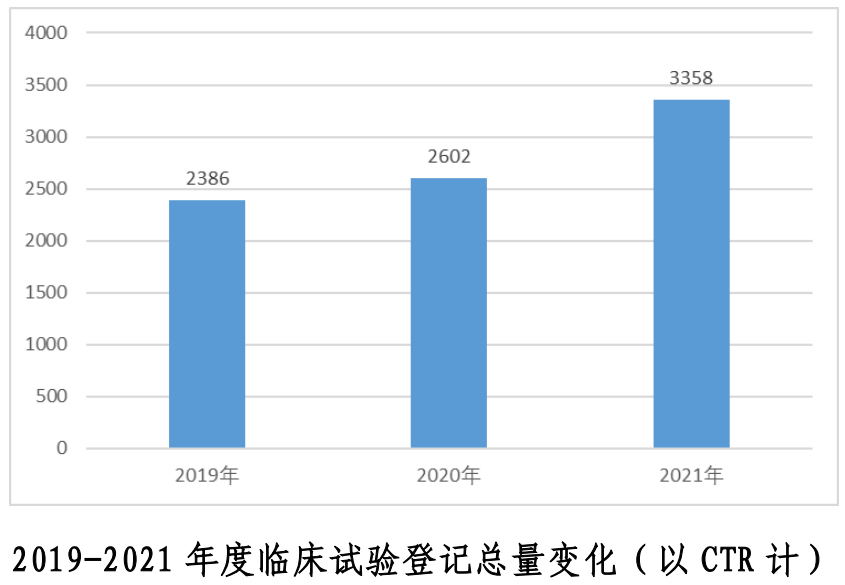
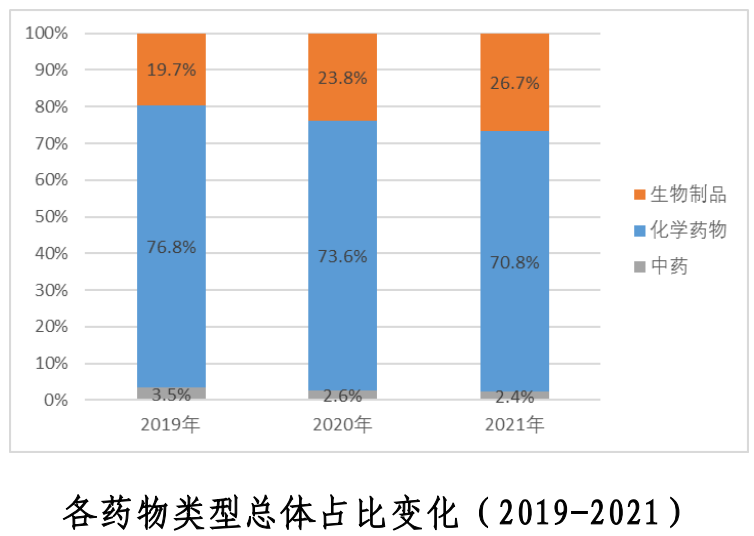
報告顯示,我國藥物臨床試驗年度登記總量首次突破3000項,共計3358 項,較上一年度增加29.1%。2021年新藥臨床試驗數量為2033項,占比增至60.5%。從研究結果來看,化學藥和生物制品的新藥臨床試驗占比較高,年均分別為54.6%和40.4%。
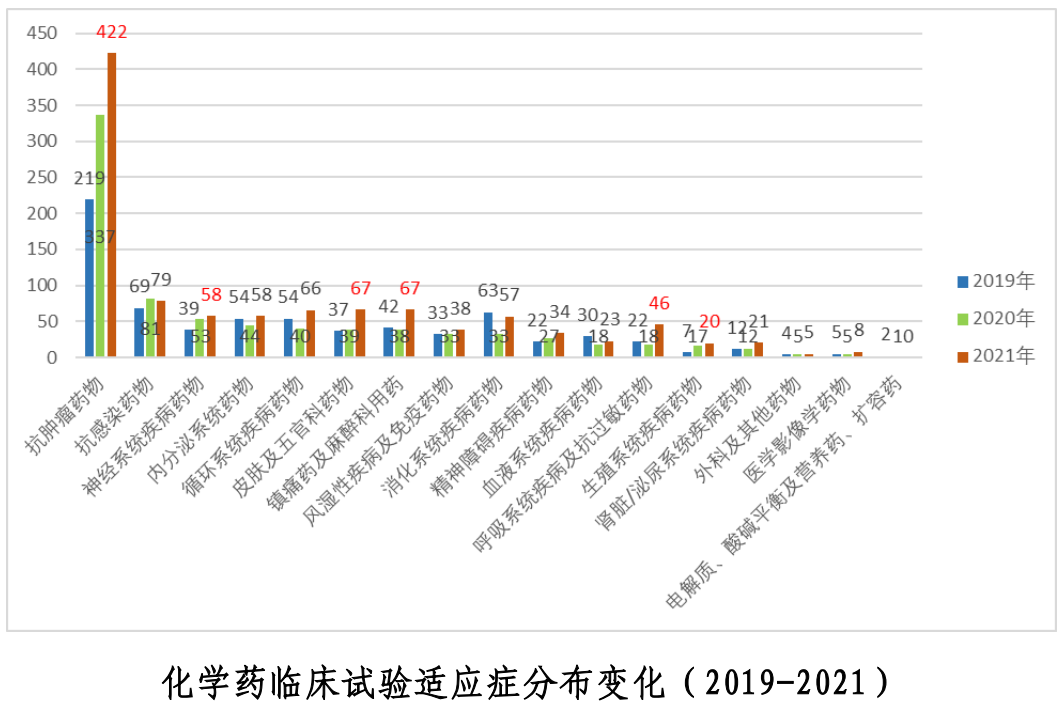
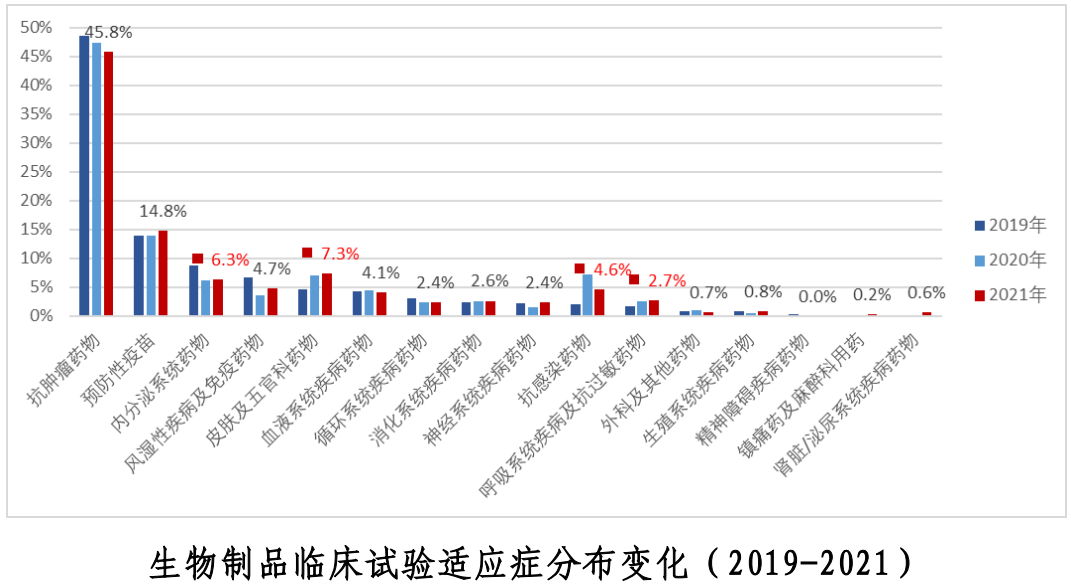
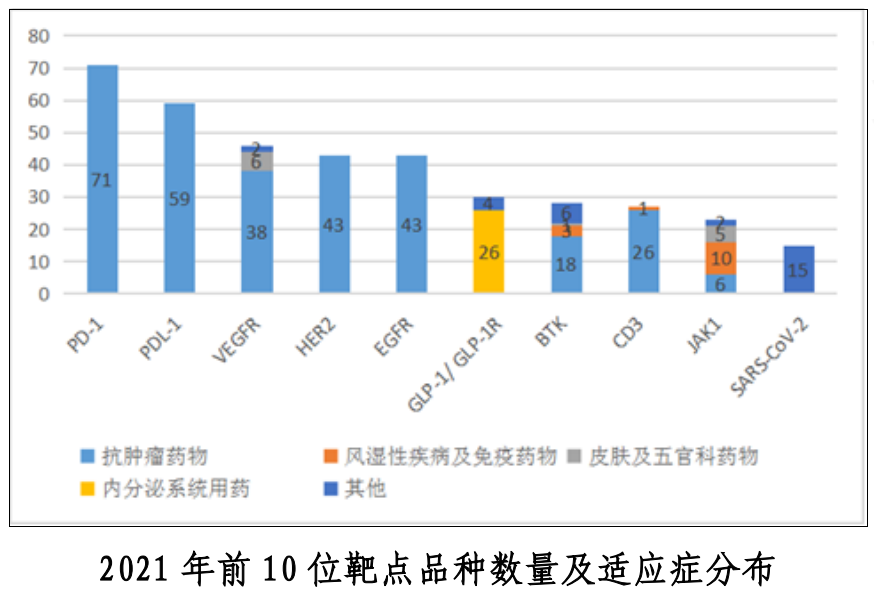
近三年中,藥物作用靶點主要集中在了PD-1和PD-L1,適應癥則主要集中在抗腫瘤領域。從試驗分期分析,PD-1和PD-L1靶點Ⅲ期臨床試驗的比例亦高于其他靶點。中藥近三年的臨床試驗主要集中在了呼吸、消化、心血管和精神神經4個適應癥。
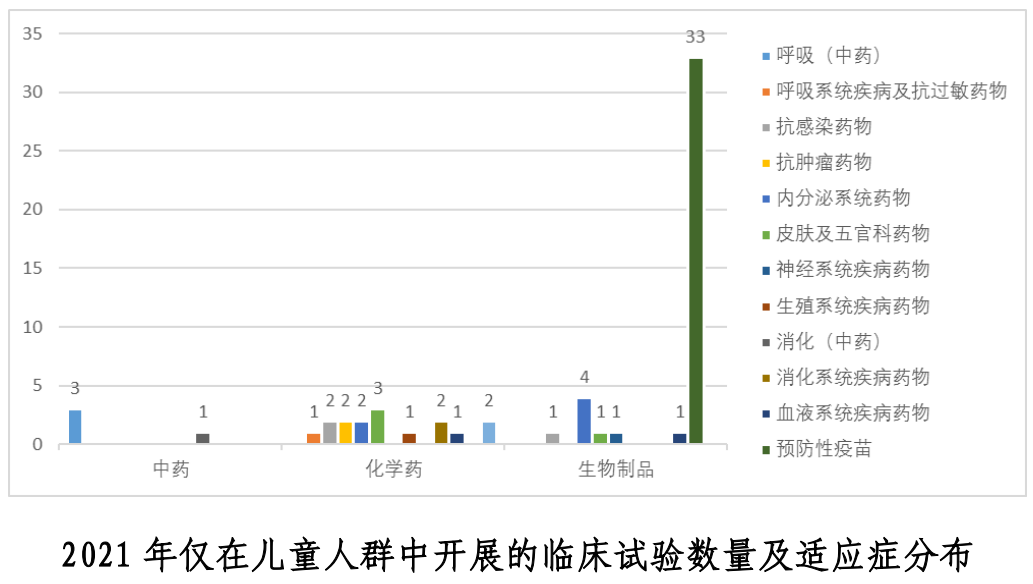
受新冠疫情因素影響,2021 年新型冠狀病毒滅活疫苗臨床試驗數量位居預防性疫苗類試驗首位(20 項)。在老年人群和兒童人群(預防性疫苗除外)中開展的臨床試驗占比仍較低,罕見疾病藥物臨床試驗涉及的疾病種類仍較少。
綜合來看,中國新藥臨床試驗數量不斷增加,且多為由境內申辦者啟動實施的新藥臨床試驗。隨著新藥Ⅲ期臨床試驗數量不斷增加,預期中國新藥上市申請數量會增加,進程會加快,滿足中國患者的新藥治療需求,包括兒科人群和罕見病的臨床用藥需求。
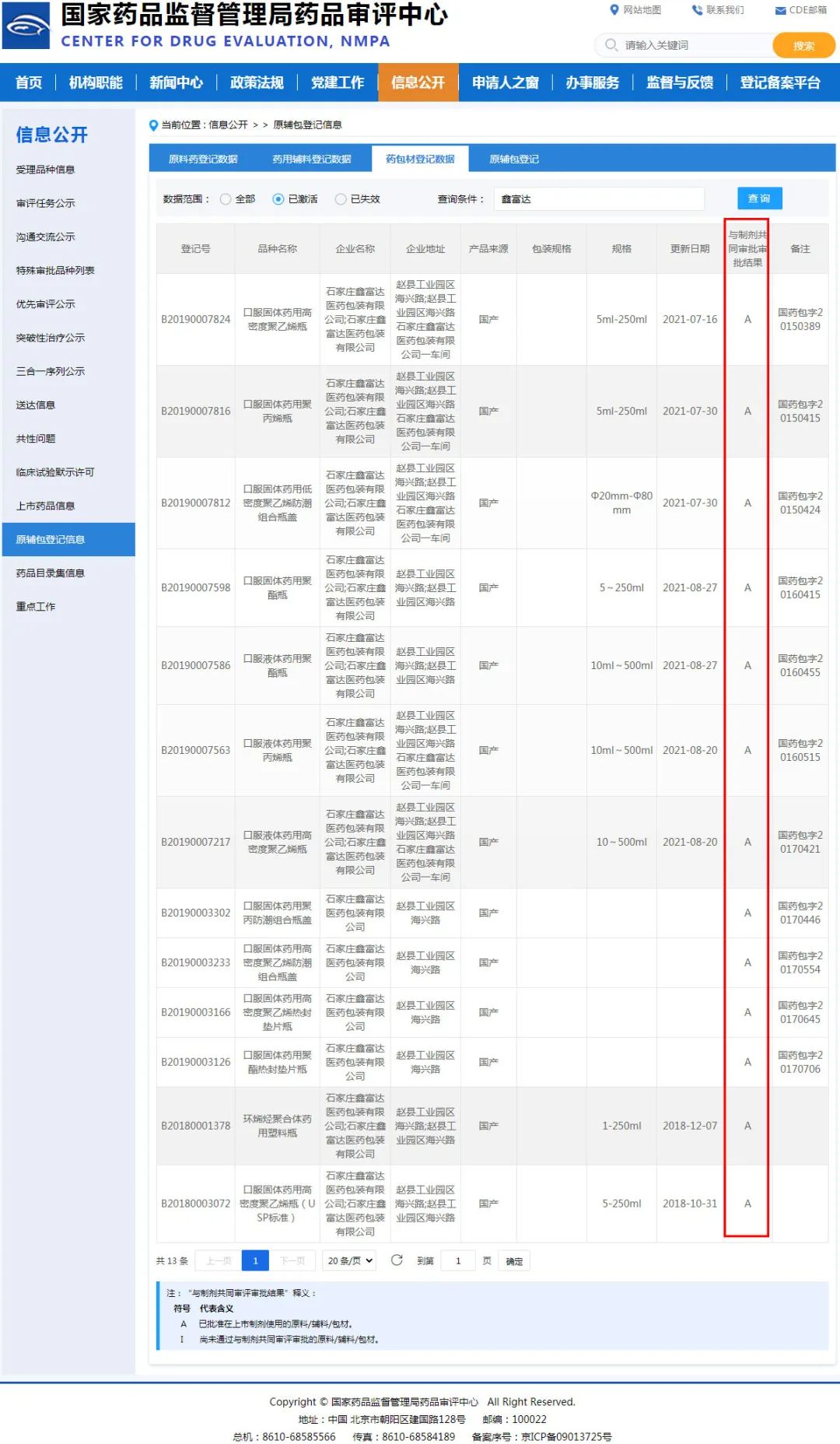
在藥物臨床階段,藥包材也是非常重要的一個方面。自2016年實施原輔包關聯審評制度以來,簡化了審批流程,藥包材生產企業與制藥企業的聯系更加緊密,也更加注重藥包材本身的保護性、功能性、穩定性,以及與藥品的相容性研究。選擇一款關聯審批為激活狀態的藥品包裝,可以省去對包材自身的安全性審查,直接進行包材與藥物的安全性、相容性研究,從而加快藥物審批進程。

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃