
附件:9251 細(xì)菌內(nèi)毒素檢查法應(yīng)用指導(dǎo)原則草案公示稿(第一次)
9251 細(xì)菌內(nèi)毒素檢查法應(yīng)用指導(dǎo)原則
本指導(dǎo)原則是對(duì)細(xì)菌內(nèi)毒素檢查法的內(nèi)容及應(yīng)用做進(jìn)一步的說(shuō)明。
1. 細(xì)菌內(nèi)毒素限值的設(shè)定
產(chǎn)品的細(xì)菌內(nèi)毒素限值一般是通過(guò)公式 L=K/M 計(jì)算得到的。其中 M 為人用每千克體重每小時(shí)最大供試品劑量,可參考藥品說(shuō)明書(shū)或具有權(quán)威性資料的用法用量。
制定品種細(xì)菌內(nèi)毒素限值時(shí),應(yīng)考慮以下情況。
(1)聯(lián)合用藥應(yīng)考慮其他制劑可能引入的細(xì)菌內(nèi)毒素;兒科用藥、營(yíng)養(yǎng)不良用藥和惡病質(zhì)用藥等,應(yīng)考慮細(xì)菌內(nèi)毒素對(duì)體弱患者人群可能導(dǎo)致更嚴(yán)重的影響。因此,制定上述品種細(xì)菌內(nèi)毒素限值時(shí),可在計(jì)算值的基礎(chǔ)上適當(dāng)嚴(yán)格。
(2)100ml 及以上裝量的大輸液類制劑,其細(xì)菌內(nèi)毒素限值一般不得超過(guò) 0.50EU/ml。
(3)制定具有多種規(guī)格注射液的細(xì)菌內(nèi)毒素限值時(shí),限值的單位應(yīng)與產(chǎn)品臨床用法用量(M)的標(biāo)示單位一致,如 EU/mg、EU/U 或 EU/ml。
(4)注射或植入眼內(nèi)的藥物產(chǎn)品,其細(xì)菌內(nèi)毒素限值一般不得超過(guò) 2.0 EU/劑。眼科沖洗產(chǎn)品的內(nèi)毒素限值一般不得超過(guò) 0.5 EU/ml。制定原料藥的細(xì)菌內(nèi)毒素限度值時(shí),應(yīng)參考其制劑的細(xì)菌內(nèi)毒素限值。
(4)制定原料藥的細(xì)菌內(nèi)毒素限度值時(shí),應(yīng)參考其制劑的細(xì)菌內(nèi)毒素限.
(5)制定原輔料和藥包材的細(xì)菌內(nèi)毒素限值時(shí),應(yīng)根據(jù)制劑內(nèi)毒素控制的要求,基于風(fēng)險(xiǎn)評(píng)估,采用具體問(wèn)題具體分析的原則。應(yīng)根據(jù)其在制劑中的用量,結(jié)合生產(chǎn)工藝,評(píng)估各組分對(duì)制劑引入細(xì)菌內(nèi)毒素污染的潛在風(fēng)險(xiǎn),合理分配每一種成分和藥包材的內(nèi)毒素限值。以確保即使每種成分和藥包材細(xì)菌內(nèi)毒素污染達(dá)到其限值,按照批準(zhǔn)的生產(chǎn)工藝生產(chǎn)的制劑細(xì)菌內(nèi)毒素檢查仍符合規(guī)定。
2. 細(xì)菌內(nèi)毒素檢查方法的選擇
細(xì)菌內(nèi)毒素檢查法(通則 1143)包括凝膠法檢測(cè)和光度檢測(cè)技術(shù)法共 6種細(xì)菌內(nèi)毒素檢查方法。供試品檢測(cè)時(shí)可以選用其中任何一種方法進(jìn)行細(xì)菌內(nèi)毒素檢查。
(1)凝膠法檢測(cè)技術(shù) 凝膠法檢測(cè)技術(shù)的優(yōu)點(diǎn)是操作簡(jiǎn)便,供試品在排除干擾作用后均可使用凝膠法檢測(cè)技術(shù)進(jìn)行檢驗(yàn)。
凝膠法檢測(cè)技術(shù)的干擾試驗(yàn)是確定供試品能否使用凝膠法檢測(cè)技術(shù)的決定因素。進(jìn)行干擾實(shí)驗(yàn)時(shí),應(yīng)挑選與鱟試劑反應(yīng)呈陰性的樣品進(jìn)行。
若樣品稀釋到 MVD 仍不能排除干擾作用,應(yīng)進(jìn)一步對(duì)供試品的前處理進(jìn)行研究,再用干擾試驗(yàn)驗(yàn)證能否使用凝膠法檢測(cè)技術(shù)。
(2)光度法檢測(cè)技術(shù) 光度法檢測(cè)技術(shù)(包括濁度法和顯色法)可定量檢測(cè)內(nèi)毒素的含量,能較為準(zhǔn)確評(píng)估產(chǎn)品在生產(chǎn)過(guò)程中污染的相對(duì)風(fēng)險(xiǎn),定量檢測(cè)的數(shù)據(jù)不僅有利于追蹤產(chǎn)品質(zhì)量趨勢(shì),還能起到風(fēng)險(xiǎn)預(yù)警的作用,達(dá)到數(shù)據(jù)完整性的要求。
供試品能否采用光度法檢測(cè)技術(shù)進(jìn)行檢測(cè),須通過(guò)干擾試驗(yàn)確定。光度法檢測(cè)技術(shù)測(cè)定法可通過(guò)回收率判斷出干擾的趨勢(shì),尤其對(duì)于研究性質(zhì)的樣品(如新產(chǎn)品)更具有優(yōu)勢(shì)。
由于光度法檢測(cè)技術(shù)的檢測(cè)范圍比凝膠法檢測(cè)技術(shù)寬,使得有干擾的樣品可以有更大的稀釋倍數(shù),對(duì)于部分使用凝膠法檢測(cè)技術(shù)無(wú)法排除干擾的樣品,可以嘗試使用光度法檢測(cè)技術(shù)建立細(xì)菌內(nèi)毒素檢測(cè)方法。
3.供試品的前處理方法
除另有規(guī)定外,一般應(yīng)使用內(nèi)毒素檢查用水(BET 水)溶解或稀釋樣品進(jìn)行細(xì)菌內(nèi)毒素檢查。常見(jiàn)的干擾因素和排除干擾的前處理方法見(jiàn)表 1。
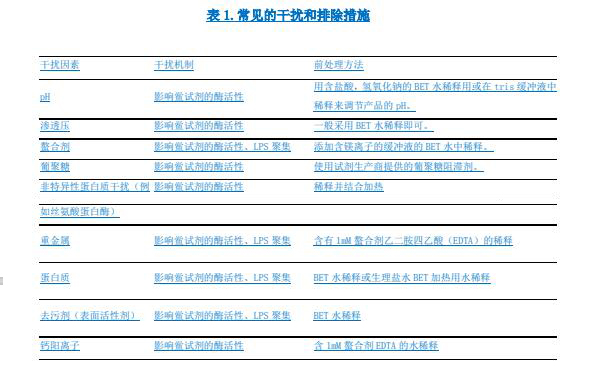
在水中溶解度低的樣品可以采取超聲波、加熱助溶、添加助溶劑、調(diào)節(jié)pH 等方法提高其溶解度。當(dāng)采用適宜的有機(jī)溶劑(乙醇、DMSO 等)進(jìn)行溶解時(shí),必須進(jìn)行干擾試驗(yàn)驗(yàn)證內(nèi)毒素的回收。
難溶性或溶解度較低的樣品可依據(jù)樣品特性,選擇適宜的方法進(jìn)行前處理,前處理包括樣品的溶解和干擾的排除。樣品的溶解方法可采用調(diào)節(jié) pH 、加熱、超聲、添加助溶劑等方式溶解,也可采用有機(jī)溶劑溶解;溶解后干擾的排除方法可采用內(nèi)毒素檢查用水稀釋、酸堿緩沖液稀釋、超濾、萃取等方式。當(dāng)采用上述方法進(jìn)行供試品前處理時(shí),應(yīng)在供試品或供試品溶液中預(yù)先添加內(nèi)毒素標(biāo)準(zhǔn)品,再與供試品同步處理后進(jìn)行干擾試驗(yàn)來(lái)驗(yàn)證前處理方法不會(huì)對(duì)內(nèi)毒素產(chǎn)生破壞或干擾作用。供試品前處理所用試劑的內(nèi)毒素含量應(yīng)對(duì)試驗(yàn)無(wú)影響。采用包合技術(shù)的新型制劑如微球、脂質(zhì)體等供試品,應(yīng)采取適宜方法將包合體破壞,使包裹在內(nèi)部的細(xì)菌內(nèi)毒素完全釋放,再進(jìn)行檢測(cè)。
對(duì)于容器類藥包材一般采用加入標(biāo)示容量的內(nèi)毒素檢查用水浸泡容器內(nèi)腔的方法進(jìn)行供試液制備;對(duì)于非容器類的藥包材,應(yīng)將藥包材置于無(wú)熱原玻璃器皿內(nèi),一般加入不超過(guò) 40mL 的細(xì)菌內(nèi)毒素檢查用水進(jìn)行供試液制備,其中針對(duì)體積較大或者較小的藥包材,可以相應(yīng)的增加或者減少提取液的體積,同時(shí)在內(nèi)毒素限量值方面做出相應(yīng)的調(diào)整。對(duì)于無(wú)菌供應(yīng)的藥包材,應(yīng)采用 37℃±1℃,提取不少于 1h 的條件制備供試液;對(duì)于非無(wú)菌供應(yīng)的包裝無(wú)菌藥品的藥包材,應(yīng)按照所包裝制劑推薦的滅菌條件進(jìn)行供試液制備。
4.產(chǎn)品細(xì)菌內(nèi)毒素檢查法的建立
建立品種的細(xì)菌內(nèi)毒素檢查法時(shí),為驗(yàn)證樣品和不同生產(chǎn)廠家鱟試劑反應(yīng)的一致性,應(yīng)使用兩個(gè)生產(chǎn)廠家的鱟試劑對(duì)至少三批樣品進(jìn)行干擾試驗(yàn)。
建立產(chǎn)品細(xì)菌內(nèi)毒素檢查法時(shí),若無(wú)法排除供試品對(duì)細(xì)菌內(nèi)毒素檢查的干擾作用,或只能使用最高靈敏度鱟試劑(凝膠法檢測(cè)技術(shù)為 0.03EU/ml,光度法檢測(cè)技術(shù)為 0.001EU/ml)才能排除干擾,則該品種不宜建立細(xì)菌內(nèi)毒素檢查項(xiàng)。
5.其他
5.1實(shí)驗(yàn)時(shí),當(dāng)使用規(guī)格大于 0.1ml/支裝量的鱟試劑時(shí),為避免鱟試劑支間活性差異帶來(lái)的影響,可將鱟試劑復(fù)溶后混合,再分裝到反應(yīng)容器中使用。凝膠法檢測(cè)技術(shù)常用的反應(yīng)容器為適宜的玻璃小試管或空安瓿等,光度法檢測(cè)技術(shù)常用的反應(yīng)容器為測(cè)定儀專用試管或酶標(biāo)板。塑料材質(zhì)可能會(huì)引起干擾,使用前應(yīng)進(jìn)行驗(yàn)證。
5.2 采用凝膠法檢測(cè)技術(shù)檢驗(yàn)時(shí),如果計(jì)算出的 MVD 值不是整數(shù),可以使用小于 MVD 的整數(shù)進(jìn)行實(shí)驗(yàn)。當(dāng)出現(xiàn)陽(yáng)性結(jié)果時(shí),為判斷產(chǎn)品是否合格,需采用計(jì)算的 MVD 重新測(cè)試。當(dāng)遇到不合格結(jié)果時(shí),應(yīng)進(jìn)行全面的回顧調(diào)查,確定試驗(yàn)的有效性。為了獲得不合格供試品的細(xì)菌內(nèi)毒素含量值,凝膠檢測(cè)和光度檢測(cè)中均可以采用超過(guò) MVD 的稀釋倍數(shù)進(jìn)行檢驗(yàn)。
目前新的細(xì)菌內(nèi)毒素檢測(cè)方法不斷出現(xiàn),以適應(yīng)特殊品種細(xì)菌內(nèi)毒素檢查的需要,或減少鱟試劑的使用量。
5.3 供試品和鱟試劑的加樣量一般為 0.1ml,也可采用其他加樣量進(jìn)行內(nèi)毒素檢測(cè),如采用小于 0.1ml 加樣量開(kāi)展凝膠試驗(yàn),或采用其他加樣量進(jìn)行動(dòng)態(tài)顯色法。動(dòng)態(tài)顯色法加樣體積、預(yù)設(shè) OD 值、所用微孔板等,應(yīng)參照試劑生產(chǎn)商的相關(guān)說(shuō)明使用。如采用的加樣量較小時(shí),實(shí)驗(yàn)的準(zhǔn)確性更容易受試驗(yàn)操作、環(huán)境污染、試管孔徑(如凝膠試驗(yàn)因所用的試管孔徑較小而受表面張力影響,使鱟試劑與樣品的反應(yīng)混合物流動(dòng)較慢,易被誤判為凝膠形成,
應(yīng)注意觀察)等外界條件的影響,因此對(duì)試驗(yàn)人員的操作水平和環(huán)境的清潔度有較高的要求。結(jié)果如有爭(zhēng)議時(shí),可采用加樣量為 0.1ml 的凝膠限度實(shí)驗(yàn)進(jìn)行仲裁。
5.4 低內(nèi)毒素回收,也稱為內(nèi)毒素掩蔽,是指無(wú)法使用細(xì)菌內(nèi)毒素檢查法正常檢測(cè)到無(wú)菌制劑 (特別是蛋白類生物制劑)中的加標(biāo)內(nèi)毒素的現(xiàn)象。判斷低內(nèi)毒素回收的方法是將已知濃度的標(biāo)準(zhǔn)內(nèi)毒素添加到未稀釋的樣品中,隨著時(shí)間的推移,標(biāo)準(zhǔn)內(nèi)毒素的回收率無(wú)法達(dá)到≥50%。低內(nèi)毒素回收會(huì)導(dǎo)致樣品中的內(nèi)毒素污染水平可能被低估或未被檢測(cè)出。該現(xiàn)象無(wú)法通過(guò)稀釋來(lái)排除,需要在建立樣品內(nèi)毒素檢測(cè)方法時(shí)進(jìn)行研究。
對(duì)于存在低內(nèi)毒素回收現(xiàn)象的產(chǎn)品,可通過(guò)調(diào)整樣品處理或試驗(yàn)方法來(lái)恢復(fù)對(duì)細(xì)菌內(nèi)毒素的檢測(cè)能力。緩解低內(nèi)毒素回收的措施應(yīng)結(jié)合產(chǎn)品本身特性,采用在樣品中添加分散劑、添加過(guò)量的二價(jià)金屬離子、使用有機(jī)溶劑增加樣品的疏水性等方式。如無(wú)法緩解低內(nèi)毒素回收現(xiàn)象,應(yīng)采用熱原檢查法或其他替代方法。
5.5 重組 C 因子法(見(jiàn)本通則附:重組 C 因子法)、微量凝膠法等為細(xì)菌內(nèi)毒素檢查法的補(bǔ)充方法。當(dāng)采用重組 C 因子法細(xì)菌內(nèi)毒素檢查法(通則 1143)中未收載的方法檢測(cè)產(chǎn)品的細(xì)菌內(nèi)毒素時(shí),應(yīng)符合“凡例”的相關(guān)規(guī)定。
附重組 C 因子法
C 因子是鱟試劑中對(duì)細(xì)菌內(nèi)毒素敏感的蛋白,能夠選擇性識(shí)別內(nèi)毒素。重組 C 因子是一種人工合成的 C 因子,它被細(xì)菌內(nèi)毒素活化后,可與熒光底物作用產(chǎn)生與內(nèi)毒素濃度成比例的熒光信號(hào)。
本法系依據(jù)反應(yīng)混合物中的內(nèi)毒素濃度和其孵育終止時(shí)的熒光值之間存在量化關(guān)系來(lái)測(cè)定細(xì)菌內(nèi)毒素的含量。本法為終點(diǎn)熒光法。依據(jù)檢測(cè)原理, 本法不存在 G 因子旁路干擾,具有較高的專屬性,因此適合于含有β葡聚糖干擾的樣品檢測(cè);本法所用試劑不含有 B 因子和凝固酶原、凝固蛋白原等,因此含有對(duì)上述物質(zhì)抑制或增強(qiáng)作用的樣品適合使用重組 C 因子法。
重組 C 因子法試驗(yàn)需采用熒光酶標(biāo)儀,其激發(fā)和發(fā)射波長(zhǎng)等參數(shù)參照試劑的使用說(shuō)明書(shū),激發(fā)/發(fā)射波長(zhǎng)一般為:380nm/440nm,檢測(cè)溫度一般為 37℃±1℃。儀器靈敏度(增益值)調(diào)節(jié)、重組 C 因子試劑的配制方法、保溫時(shí)間等,參照所用儀器和試劑的有關(guān)說(shuō)明進(jìn)行。
標(biāo)準(zhǔn)曲線的可靠性試驗(yàn)、干擾試驗(yàn)、檢查法以及結(jié)果判斷 參照細(xì)菌內(nèi)毒素檢查法(通則 1143)中的方法 2 光度法檢測(cè)技術(shù)。
起草單位:中國(guó)食品藥品檢定研究院 聯(lián)系電話:010-53851594
9251 細(xì)菌內(nèi)毒素檢查法應(yīng)用指導(dǎo)原則修訂說(shuō)明
本次修訂的主要內(nèi)容說(shuō)明如下:
1.在“細(xì)菌內(nèi)毒素限值的設(shè)定”項(xiàng)下,參考 USP 1085,新增了眼科用藥的內(nèi)毒素限值制定;將原料、輔料、包材限度制定綜合考慮制定要求。
2.在“供試品的前處理方法”項(xiàng)下,參考 USP 1085,增加了常見(jiàn)的干擾和排除措施;對(duì)難溶性樣品的前處理方法和要求,進(jìn)行詳細(xì)描述;增訂藥包材樣品的前處理方法。
3.在“其他”項(xiàng)下,提出使用塑料材質(zhì)試管需先進(jìn)行驗(yàn)證的要求;參考USP 1085,增加當(dāng)遇到不合格結(jié)果時(shí)的相關(guān)建議;增加當(dāng)采用小于 0.1ml 加樣量開(kāi)展內(nèi)毒素試驗(yàn)時(shí)應(yīng)注意的問(wèn)題;增加對(duì)低內(nèi)毒素回收現(xiàn)象的描述,以及處理方法的介紹;明確重組 C 因子法為細(xì)菌內(nèi)毒素檢查法補(bǔ)充方法。
4.全文依據(jù) 1143 細(xì)菌內(nèi)毒素檢查法 的修訂,對(duì)本文中凝膠試驗(yàn)和光度試驗(yàn)的方法名稱進(jìn)行相應(yīng)的修改。
來(lái)源:藥典委
![]() 附件 9251細(xì)菌內(nèi)毒素檢查法應(yīng)用指導(dǎo)原則草案公示稿(第一次).pdf
附件 9251細(xì)菌內(nèi)毒素檢查法應(yīng)用指導(dǎo)原則草案公示稿(第一次).pdf

 冀公網(wǎng)安備 13010802000997號(hào)
冀公網(wǎng)安備 13010802000997號(hào) 微信掃一掃
微信掃一掃