
一、概述
司美格魯肽注射液是丹麥諾和諾德公司開發的一種長效人胰高血糖素樣肽-1(GLP-1)受體激動劑。與天然 GLP-1 相 比,司美格魯肽的半衰期較長,約為 1 周,使其適合每周一次皮下給藥。司美格魯肽注射液在 2017 年開始先后獲得美國、歐盟批準上市,用于 2 型糖尿病成人患者的血糖控制[1-2],商品名:Ozempic 8?。司美格魯肽注射液于 2021 年 4 月獲批進口中國,適用于成人 2 型糖尿病患者的血糖控制[3],商品名:諾和泰? 9(Ozempic 10 ?),規格:1.34mg/ml,1.5ml(預填充注射筆)和 1.34mg/ml,3ml(預填充注射筆)。
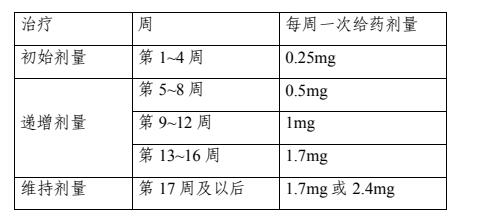
2021 年 6 月,司美格魯肽注射液在美國獲批體重管理適應癥,商品名 Wegovy 13 ?,規格0.25mg/0.5ml、0.5mg/0.5ml、1mg/0.5ml、1.7mg/0.75ml、2.4mg/0.75ml,適用于在減少熱量飲食和增加體力活動的基礎上對成人患者的長期體重管理,初始體重指數(BMI)符合以下條件:≥30kg/m2(肥胖),或≥27kg/m2至<30kg/m2(超重)且存在至少一種體重相關合并癥(例如高血壓、2 型糖尿病或血脂異常)[4]。2023 年 7 月更新用法用量:以 0.25mg 劑量開始司美格魯肽皮下注射,每周一次。遵循表 1 中的推薦給藥方案,以盡量減少胃腸道不良反應;成人維持劑量為 2.4mg(推薦)或 1.7mg 每周一次 [5]。此外,司美格魯肽注射液已在歐盟[6]、日本批準用于體重管理適應癥。
表 1 推薦給藥方案
為了更好地推動我國生物類似藥的研發,在原國家食品藥品監督管理總局已發布的《生物類似藥研發與評價技術指導原則(試行)》[7]基礎上,結合目前溝通交流經驗,討論形成對司美格魯肽注射液生物類似藥體重管理適應癥臨床試驗設計的建議,為研發機構和研究者提供參考。
本指導原則僅代表藥品監管部門當前的觀點和認知。隨著科學研究的進展,本指導原則中的相關內容將不斷完善與更新。應用本指導原則時,請同時參考藥物臨床試驗質量管理規范(Good Clinical Practice,GCP)、人用藥品技術要求國際協調理事會(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)和其他國內已發布的相關指導原則。
二、司美格魯肽注射液生物類似藥臨床研發要求
司美格魯肽注射液生物類似藥應以在我國上市的原研藥為參照藥,上市許可持有人為丹麥諾和諾德公司 Novo Nordisk A/S,開展藥代動力學比對試驗和臨床安全有效性比對試驗,以支持按生物類似藥注冊上市。藥代動力學比對試驗需要在健康受試者中,完成與原研藥比對的一項單次給藥生物等效性研究,驗證試驗藥與原研藥 PK 特征的相似性。臨床安全有效性比對試驗需選擇不合并 2 型糖尿病的中國肥胖人群,與原研藥進行一項臨床等效性比對研究。
三、體重管理適應癥臨床試驗設計要點
生物類似藥臨床試驗應進行科學合理的設計,證明試驗藥與參照藥的相似性。健康受試者藥代動力學比對試驗 試驗設計:司美格魯肽注射液半衰期較長,且具有免疫原性,建議采用單次給藥的隨機、平行對照的試驗設計。在藥學物質基礎一致的前提下,若同時申報 2 型糖尿病適應癥和體重管理適應癥,可共用一套 PK 比對研究數據。
研究人群:健康受試者是評價試驗藥與參照藥的藥代動力學差異的敏感人群,需注意選擇的兩組受試者基線可比。
建議根據司美格魯肽注射液 PK 參數的變異度、等效性界值、置信區間和把握度等參數計算樣本量。劑量及給藥途徑:原則上應選擇能檢測出試驗藥與參照藥的 PK 差異的敏感劑量開展研究,PK 比對研究中應選擇的給藥劑量為 0.25mg。皮下給藥時盡量選擇相同注射部位,將有利于敏感評價試驗藥與參照藥的 PK 差異。
采樣點設計:采樣點設計以能夠準確反映試驗藥和參照藥整體 PK 特征為原則,應包括吸收相、分布相和末端消除相,并滿足 AUC0-t/ AUC0-∞比值大于 80%。終點指標與界值:以司美格魯肽的 Cmax、AUC0-t、和 AUC0-∞作為主要終點指標,試驗藥與參照藥主要終點指標幾何均值比的 90%置信區間應在 80.00%~125.00%范圍內。建議提供全面的 PK 參數,包括但不限于 Cmax、tmax、AUC0-t、AUC0-∞、AUC0-t/AUC0-∞比值、表觀分布容積、清除率和消除半衰期等,對次要終點指標進行描述性比較分析。
(二)臨床有效性比對試驗
試驗設計:臨床有效性比對目的是證明試驗藥與原研藥臨床療效相似,應遵循以原研藥為對照,進行隨機、平行對照、等效性設計。
研究人群:選擇不合并 2 型糖尿病的肥胖人群。體重指數 BMI 界值建議參照中國對超重和肥胖的判定標準,選擇78 BMI≥28.0 kg/m2的肥胖受試者,以減少臨床試驗過程中受試者脫落。
給藥方案/劑量:以 0.25mg 劑量開始司美格魯肽皮下注射,每周一次。遵循表 1 中的推薦給藥方案。對于維持劑量,可以選擇 1.7mg 或 2.4mg 中的一種劑量作為維持劑量,同一研究中僅可選擇一種維持劑量。
表 1 推薦給藥方案
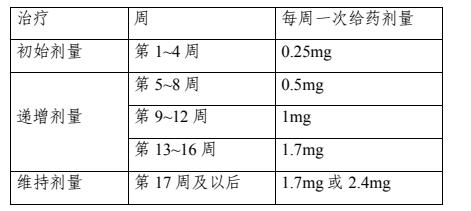
試驗療程:總療程為 44 周。如維持劑量為 1.7mg,應包括 12 周的劑量滴定期和 32 周的劑量維持期;如維持劑量為2.4mg,應包括 16 周的劑量滴定期和 28 周的劑量維持期。
評價指標:主要評價指標以治療 44 周后試驗藥組和原研參照組之間體重相對基線下降百分比的差值。次要療效指標建議包括體重相對基線下降百分比≥5%的受試者比例、腰圍指標等,不必設置過多的次要療效指標。
等效性界值:匯總司美格魯肽兩項國外關鍵性研究STEP 1、STEP 3(68 周)和一項以中國人群為主的研究(44 周)的臨床療效數據,計算試驗組與安慰劑組治療后體重較基線變化的百分比差值的 Meta 分析結果。建議將體重較基線變化的百分比差值的等效性界值按組間均數差值雙側的95%置信區間設定為±4.16%。
樣本量:試驗前需充分估計所需的樣本量,通常建議α取雙側 0.05(雙單側 0.025),檢驗效能至少 80%。
(三)其他需要重點關注的問題
1、安全性
在藥代和有效性比對試驗研究中均應考察不良反應發生的類型、嚴重性和頻率等進行比較,尤其是特定的重點關注的不良反應。
2、免疫原性研究
應在臨床比對試驗中檢測抗藥抗體(ADA)和中和抗體(Nab),通過抗藥抗體/中和抗體陽性率、抗體滴度、抗體出現時間等進行評價。建議對所有受試者進行樣本檢測,采樣點應至少包括首次給藥前、半程治療及末次給藥后。
3、患者藥代動力學研究
考慮到司美格魯肽在健康受試者和肥胖/超重患者中吸收、代謝和清除途徑基本一致,可不在肥胖患者中開展 PK 比較研究。
四、小結
司美格魯肽注射液生物類似藥體重管理適應癥的研發應遵循生物類似藥指導原則的一般要求,目前認為臨床相似性評價應至少包括一項藥代動力學比對試驗和一項臨床比對試驗。本文對司美格魯肽注射液生物類似藥的體重管理適應癥研究設計要點進行了闡述,對于未能覆蓋的問題,鼓勵申請人積極與監管機構進行溝通交流。
來源:CDE
![]() 《司美格魯肽注射液生物類似藥體重管理適應癥臨床試驗設計指導原則(征求意見稿)》.pdf
《司美格魯肽注射液生物類似藥體重管理適應癥臨床試驗設計指導原則(征求意見稿)》.pdf

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃