
無菌藥品包裝系統密封性指導原則
本指導原則闡述無菌藥品包裝系統的泄漏方式、泄漏風險、密封性試驗方法選擇、方法驗證和結果評價等相關要求,為無菌藥品包裝系統密封性研究和評價提供指導。
包裝系統密封性(Package integrity),與容器密閉系統密封性(Container closure integrity,CCI)同義,是指包裝系統能夠防止內容物損失,阻止微生物及可能影響藥品質量的氣體或其他物質的進入,保證藥品符合必要的安全與質量標準。
包裝系統密封性試驗( Package integrity test ),與容器密閉系統密性 試 驗(Container–closure integrity test, CCIT)或包裝系統的泄漏試驗(Package leak test)同義,指檢測存在破裂或縫隙的包裝系統產生任何泄漏的試驗(包括理化或微生物試驗方法),些檢測可以確定泄漏的尺寸和/或位置。包裝密封質量檢測(Package seal quality test)是用于表征和監控與包裝的密封有關的參數質量和一致性的檢測,包裝的密封質量可能影響包裝保持完整性的能力。
最大允許泄漏限度(Maximum allowable leakage limit,MALL)指特定產品包裝所能允許的最大泄漏率(或泄漏尺寸),該泄漏率(或泄漏尺寸)不影響產品質量,也不會對產品安全構成風險。固有包裝完整性(Inherent package integrity)指采用無缺陷包裝組件組裝完好的容器密閉系統的泄漏率(或泄漏尺寸),可以衡量容器密閉系統的密封完整性。可接受的固有包裝完整性應符合特定產品包裝最大允許泄漏限度。確定性泄漏試驗方法(Deterministic leak test method)在確定性泄漏試驗方法中,要檢測的泄漏是基于一系列可預見的事件。確定性泄漏試驗是基于容易控制和監測的理化技術,獲得客觀的定量數據。
概率性泄漏試驗方法(Probabilistic leak test method)與確定性泄漏試驗方法相反,具有隨機的特點。概率試驗取決于一系列連續和/或同時發生的事件,每個事件均與由概率分布表述的隨機結果相關,因此結果具有不確定性,需要大的樣本量和嚴格的試驗條件控制,以獲得有意義的結果。
陰性對照(Negative control)是無已知泄漏的包裝,是泄漏試驗方法建立和驗證中采用正常工藝組裝組件的最佳包裝。陰性對照在產品包裝系統密封性試驗中應可重現。模具控制樣品(Master)是模擬實際包裝的形狀和設計而制作的包裝原型、模型或樣板。可由實心塑料或金屬制成,或者只是一個特定的密封容器單元。用于模擬無泄漏的包裝,通常用于系統適用性試驗以驗證儀器性能。
陽性對照(Positive control)指具有已知故意缺陷的包裝,用于泄漏試驗方法建立和驗證研究。陽性對照應在包裝系統構造、組裝和組件加工的材料方面與陰性對照一致。
泄漏(Leakage)是物質(固體、液體或氣體)通過包裝壁上的破損處或通過包裝組件之間的間隙進入或逃逸。
氣體泄漏率(Gaseous leakage rate)是在特定溫度和絕對壓力或濃度差條件下通過泄漏路徑的氣體流速(以質量或體積為單位)的量度。泄漏率的大小是壓力乘以體積再除以時間。如國際標準單位(SI)是帕斯卡立方米每秒(Pa·m3·s 39 -1),其他常用測量單位包括標準立方厘米每秒(std·cm3·s-1 或 sccs)和毫巴升每秒(mbar·L·s?1 40 )。
一、泄漏方式及質量風險
包裝系統的密封性可實現對藥品的保護作用,藥品包裝系統都應關注泄漏對藥品質量的影響,不同的泄漏表現造成的質量風險也可能有所不同(見表 1),對于藥品有無菌要求的包裝系統更需要關注包裝系統密封性對藥品質量的影響。滲透一般指流體(如氣體)進入、通過和流出無孔包裝壁的過程,只有小部分分子能夠通過屏障,其與泄漏不同,主要與材料本身的阻隔性能有關,故不在本指導原則的范圍內。
表 1.泄漏產生的產品質量風險

二、包裝密封質量檢測
包裝密封質量與封口性能是否符合質量要求有關,如袋的熱合強度。通過檢測密封質量確保密封屬性、包裝材料、包裝組件、組裝過程始終保持在確定的范圍內。包裝密封質量檢測可表征包裝封口的質量,監控工藝參數的一致性,進一步保證包裝系統的密封性。
密封質量檢測不能替代包裝系統密封性試驗,滿足密封質量要求的包裝可能仍然存在缺陷導致泄漏,比如密封強度滿足要求的軟袋包裝系統可能因為袋體上的穿孔而發生泄漏。密封質量檢測結果可以提供包裝系統密封特性的有關信息,控制密封質量有助于保證包裝系統密封性。密封質量檢測和包裝系統密封性試驗結合起來可進一步確保包裝系統的密封性。
根據不同的密封方式,常用的密封質量檢測方法有以下幾種:1)扭矩檢測,即測量將螺紋帽蓋到螺紋口容器上施加的力或擰開螺帽所需的力來考察密封性能;2)爆破強度試驗;3)密封強度試驗,即測量剝離熱封部位兩個粘合面所需的力;4)殘余密封力(RSF)檢測,即彈性體密封件施加到注射劑瓶口上的壓縮力的間接測量;5)超聲波檢查法,通過超聲信號傳遞到包裝或物品的密封區域后,其信號強度的變化來檢查其密封質量等,方法可見本指導原則附 11。
三、產品生命周期中包裝系統的密封性研究
對包裝系統密封性的評估和監測應從產品風險管理角度出發,貫穿產品的生命周期(參見圖 1)。包裝系統密封性的保證不是僅僅通過最終產品抽樣檢查或在線檢查控制,還與包裝系統/組件的設計、選擇、生產,產品生產過程控制,貯藏運輸管理等有關。不同的包裝系統,在包裝系統/組件的開發和加工及組裝驗證階段,需確定包裝系統的固有包裝完整性,基于質量源于設計(QbD)的理念,應關注組件選擇的匹配性以及工藝參數的設定和優化;在產品的生產階段,當產品、包裝設計、包裝材料或生產/加工條件發生變更時,需考慮密封性的重新評價并在變更實施前完成風險評估;在藥品穩定性考察初期和末期進行無菌檢查,其他時間點可采用包裝系統密封性檢測替代,監測產品貯存過程中的質量變化。在產品生命周期中的各個階段不斷積累密封性評估和控制的知識、歷史數據和經驗,制定有效的密封性控制策略,有利于持續可靠地確保密封性符合預期要求。
四、密封性試驗方法
包裝系統的密封性試驗方法可按照不同的分類方式進行分類:根據試驗技術不同可分為理化方法和微生物方法。根據試驗方法產生的結果是定量結果(可進行客觀分析)還是基于對試驗樣品的特定質量、屬性或特征的主觀觀察可分為定量方法和定性方法。
根據試驗方法對包裝系統破壞與否可分為破壞性和非破壞性方法:破壞性試驗方法會損壞試驗樣品,產品不可回收使用,如微生物挑戰法等;非破壞性方法(無損檢測)不破壞產品,如質量提取法、真空衰減法等。根據試驗方法的取樣方式可分為離線和在線方法:離線方法是對非生產線上的產品進行取樣考察,可使用非破壞性或破壞性方法。在線方法是對整批產品在連續填充和密封產品的包裝制造過程中進行,應使用非破壞性方法。兩者比較而言,離線方法的檢測時間一般較在線方法的檢測時間長,比在線試驗方法更靈敏。在線方法可以即時反饋檢測結果,需要時,可實時在線校正相關參數,更好地保證所有包裝系統的密封性。
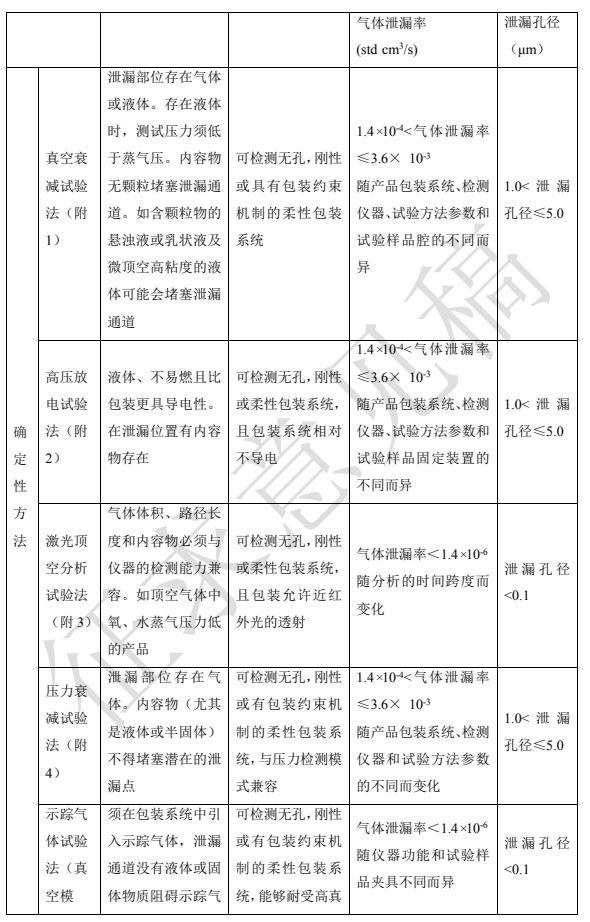
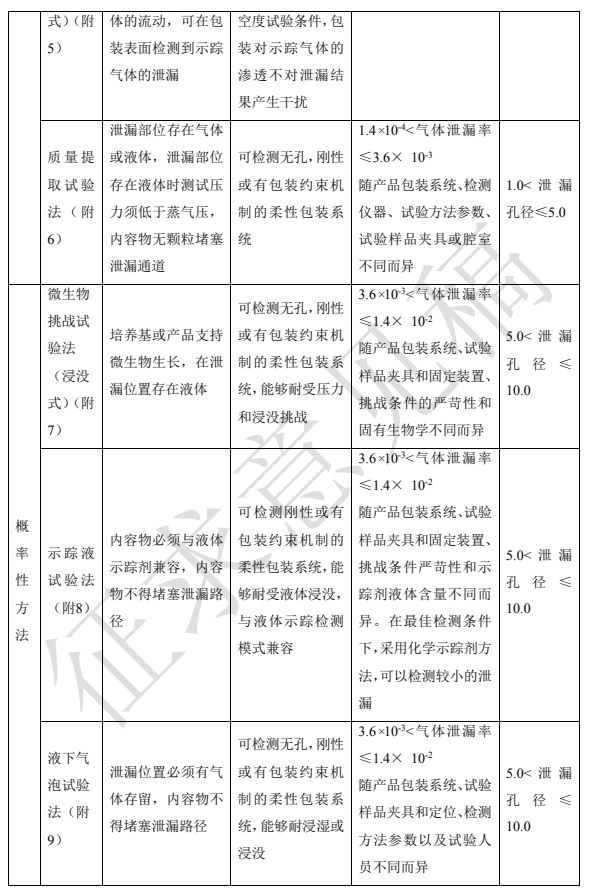
根據試驗樣品的結果是否為隨機事件可分為確定性試驗方法和概率性試驗方法。常用方法見表 2。方法具體原理、設備、操作等見本指導原則附 1 到附 10。
五、密封性試驗方法的選擇
1.方法的選擇因素
(1)包裝系統內容物的特性
根據包裝系統內容物的特性,對密封性試驗方法進行選擇。如真空衰減法要求產品不能堵塞泄漏通道;高壓放電法要求內容物為液體、不易燃且比包裝更具導電性;示蹤液試驗法要求內容物必須與液體示蹤劑兼容,內容物不得堵塞泄漏路徑;采用液下氣泡法時,泄漏位置必須有氣體存留,無顆粒物堵塞泄漏路徑;采用質量提取法時固體藥品包裝中需要有一定量的頂空氣體,產品無顆粒物堵塞泄漏路徑;采用激光頂空分析試驗法時,藥品包裝中存在頂空氣體。此外不同的方法其靈敏度各異,還需結合不同藥品質量控制要求來選擇適宜的方法。
(2) 包裝系統中組件材料的影響
對剛性材料,如玻璃包裝系統,可以承受不同壓力或真空挑戰試驗,適用的方法有真空衰減試驗法、質量提取試驗法、壓力衰減試驗法、示蹤氣體試驗法、示蹤液試驗法等。而對于塑料袋這類包裝系統,由于其材質在壓差下可能發生變形,所以在使用壓差原理的方法時,需要考慮采用特殊工具進行限位,使柔性包裝具有約束機制,防止包裝承受不同壓力時發生蠕變或破裂導致密封被破壞。透明或半透明包裝可透射激光, 也可開展目視檢查,故可采用激光頂空分析試驗法或示蹤液試驗法進行檢測。
采用質量提取或真空衰減試驗時,在真空試驗條件下,需考慮有些塑料包裝系統或含彈性體組件的包裝材料,可能會釋放揮發物,從而產生誤判。對于一些阻隔性能較差的包裝材料,采用示蹤氣體試驗法檢測時,也可能由于材料的氣體滲透對結果產生干擾。
(3)包裝系統中組件的固定性
不同包裝系統組件的配合,有些是固定的(如塑料輸液袋包裝的接口和組合蓋);有些在外力作用下可發生移動(如預灌封注射器的柱塞等)。所以選擇的密封性試驗方法如果需在不同壓力條件進行試驗(如示蹤液體試驗法、壓力衰減試驗法、真空衰減試驗法、質量提取試驗法),就需要對移動組件進行固定防止位移,保證試驗結果的準確性。
(4)包裝系統中組件的密封類型
包裝組件的密封類型按照密封機理分為物理配合和理化結合兩種。根據不同的密封類型可能產生的泄漏風險不同,可結合不同方法的特點進行選擇。物理配合密封是通過表面材料不同的兩種組件通過擠壓等方式緊密配合實現密封,如活塞插入注射器針筒內的緊密配合、彈性密封件塞入注射劑瓶瓶口等。物理密封不是兩者結合在一起,即使密閉良好的組件之間也可能存在微小的縫隙從而產生液體泄漏、微生物侵入或氣漏,但是通過適當的設計和組裝,物理配合密封也可以防止這些泄漏。理化結合密封是表面相似或不同的兩個材料通過熔融等方式實現密封,如玻璃或塑料安瓿是單一材質熔封成型,塑料軟袋是膜材通過熱焊或超聲焊接工藝完成熔封。這種方式可以有效防止液體泄漏和微生物侵入,但仍可能出現氣體泄漏。
2.密封性試驗方法的選擇
選擇密封性試驗方法時,首先考慮包裝內容物的特性,此外包裝的設計結構、包裝系統的材料、包裝系統的密封類型以及最大允許泄漏限度等均會對方法的選擇產生不同的影響,表 2 可為常用的密封性試驗方法選擇提供參考。本表中泄漏檢測限作為方法選擇時參考,實際泄漏檢測限會隨產品包裝系統、檢測儀器、檢測方法參數設定和樣品制備等不同而變化。
表2 密封性試驗方法選擇


六、密封性試驗方法驗證
密封性試驗方法驗證是為了證明針對不同包裝形式和包裝內容物,選用的試驗方法滿足相應的檢測要求,尤其需關注方法靈敏度的考察,明確方法的檢出能力。在方法驗證之前進行儀器/設備確認,包括儀器/設備的功能評估以及使用適當的校準工具或標準品來模擬泄漏檢測條件,確定儀器/設備的檢測能力。
考慮到包裝系統的設計、組件材料以及內容物等對試驗結果的影響,在方法建立和驗證中應設計和運用陽性對照以及陰性對照樣品。陽性對照樣品、陰性對照樣品與試驗樣品具有相同的包裝系統。陽性對照樣品通過適宜的陽性對照樣品制備方式制備(參照本指導原則附12),一般應制備至少 3 個不同尺寸孔徑的陽性對照樣品進行試驗。適用時,方法建立和驗證中也可采用模具控制樣品。方法驗證應結合方法的不同特點和預期用途開展,以下為方法驗證一般考察內容,可結合不同方法特點開展(見本指導原則所附各方法)。
1.專屬性 指存在可能引起誤判的干擾因素時,該方法能準確區分包裝是否泄漏的能力。
2.準確度 是正確區分泄漏超過聲稱檢測限的包裝與泄漏低于此限的包裝(即不泄漏)的能力。
3.精密度 指該方法產生可靠,可重復數據的能力。在相同條件下,由同一個分析人員測定相同樣品所得結果的精密度稱為重復性。同一個實驗室考察隨機變動因素下(如不同日期、不同人員、采用不同儀器)測得結果之間的精密度稱為中間精密度。在不同實驗室由不同分
析人員獲得樣品測定結果之間的精密度稱為重現性。
4.檢測限 指對于給定包裝系統,該泄漏試驗方法能夠可靠檢出的最小泄漏率(或泄漏尺寸),又稱檢出限。
5.定量限 指一個泄漏試驗方法在規定的試驗條件下,在可接受的準確度和精密度范圍內能確定的最小泄漏率或泄漏尺寸,且測定結果符合準確度和精密度要求。
6.線性 指試驗結果與泄漏大小或泄漏率成比例關系的能力。不同的方法其線性要求不同。
7.范圍 指特定泄漏試驗方法在適當的準確度和精密度水平下,可檢出的最小和最大漏孔(或泄漏率)的區間。不同的泄漏試驗方法適用范圍不同。
8.耐用性 指在方法參數有刻意的小變化時,該方法能夠準確識別泄漏與非泄漏包裝的能力,提示方法正常使用期間的適用性。
七、密封性試驗方法系統適用性
系統適用性是指在當前試驗環境下,設施、設備以及方法是否能夠滿足預期檢測需求。確保泄漏試驗方法所有可能產生變化或影響試驗結果的因素(如儀器、分析人員、試驗樣品制備步驟和試驗環境)被充分控制,并維持方法穩健和耐用的一種方式。通過系統適應性試驗,確認泄漏試驗方法和所有可能影響試驗結果的關鍵因素均被正確控制,并在方法實施前預先設定。系統適用性對于所有泄漏試驗方法都很重要。
八、密封性試驗樣品
開展包裝系統密封性試驗時,可根據產品生命周期不同階段的要求,結合擬用方法的特點、藥品及包裝特性以及批生產規模等,結合既往藥品生產及質量控制的經驗,如驗證階段工藝控制的統計學結果以及產品正常生產時質量趨勢的分析情況等,基于風險控制科學制定密封性試驗的供試品取樣量及抽樣方案。
九、密封性試驗結果評估
對大多數包裝類型而言,即使是配合很好的密閉系統,也會存在一定的氣體泄漏,所以評估包裝系統密封性的實際意義是考察最大允許泄漏限度是否可以保證產品的質量。應基于科學和風險確定包裝系統的最大允許泄漏限度,最大允許泄漏限度與藥品質量要求密切相關,同時需考慮在產品生命周期內的工藝、貯藏、配送和使用情況對包裝系統密封性的潛在影響。對特定的產品包裝系統,需考慮密封性缺陷大小/類型,以及與微生物侵入和/或液體通過風險的關系,建立有意義的最大允許泄漏限度。如果包裝系統的泄漏不大于最大允許泄漏限度,
可認為包裝具有良好的密封性。
考察包裝系統最大允許泄漏限度時可根據產品質量的要求,按以下類別考慮。
1.須保持產品無菌和內容物組分含量不變,但無需保證頂空氣體組分不變。該類產品最大允許泄漏限度的控制主要與內容物組分流失、外部固體、液體的進入以及微生物的污染有關。有研究表明,一定條件下,剛性包裝的液體挑戰試驗中,包裝存在標稱直徑約0.1μm的漏孔時,液體泄漏的風險較小,存在標稱直徑約0.3μm的泄漏孔徑時開始出現微生物侵入風
險。基于此研究結果,采用氦質譜(真空模式)檢查剛性包裝獲得的最大允許泄漏限度小于
6×10 187 -6mbar·L/s時,相當于存在標稱直徑0.1-0.3μm的漏孔,微生物侵入的概率小于0.10,可保證較低的微生物侵入和液體泄漏風險,可不進行額外的微生物侵入挑戰研究。
2.須保持產品無菌、內容物和頂空氣體組分不變。這類產品的包裝不僅要防止產品組分流失,產品受到外部液體、固體物質或微生物污染,還必須能保持頂空氣體的組成不變(如真空包裝或充氮產品等)。產品的最大允許泄漏限度可根據最大允許包裝頂空氣體含量或壓力隨時間變化趨勢來確定,必要時還需考慮滲透帶來的影響。
3.多次使用的無菌產品。這類產品為多劑量包裝,可能采用過濾器、活塞或其他組件,防止產品使用及兩次使用之間微生物侵入和產品泄漏風險的發生。如注射劑產品的彈性密封件,注射針穿刺使用后,其具有的自密封性可以在穿刺后對藥品提供再保護,以確保其使用期間產品損失和微生物侵入的風險降到最低;多劑量眼用制劑包裝封口設計有過濾器、塞子等,允許產品使用的同時限制微生物進入和產品泄漏。此類產品的最大允許泄漏限度可根據微生物侵入風險、預防產品損失和產品質量要求等確定。上述 1、2 類產品包裝的密封性要求也適用于多次使用的無菌產品。
不同的密封性試驗方法在適用范圍、檢測限等方面不盡相同,沒有一種泄漏試驗方法可適用于所有包裝系統,對不同的藥品及包裝系統,需結合產品的特點進行方法選擇。對包裝系統密封性的評價包括但不限于密封性試驗結果,還應結合包裝系統組件構成和工藝特點,生產時工藝控制的統計結果和質量趨勢分析來綜合評價。
來源:藥典委
原文下載:![]() 無菌藥品包裝系統密封性指導原則標準草案征求意見稿(24年12月).pdf
無菌藥品包裝系統密封性指導原則標準草案征求意見稿(24年12月).pdf

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃