
規定了口服固體藥用高密度聚乙烯防潮組合瓶蓋、質量標準、試驗方法和檢驗規則,以及標志、包裝、運輸和貯存。本標準適用于以高密度聚乙烯為主要原料生產的口服固體藥用塑料瓶蓋,采用注塑成型工藝生產的塑料產品的生產和質量控制。
下列文件中的條款通過本標準的引用而成為本標準的條款
YBB00172004-2015口服固體藥用低密度聚乙防潮組合瓶蓋
YBB00122002-2015口服固體藥用高密度聚乙烯瓶
YBB00122005-2015固體藥用紙袋硅膠于燥劑
1.2外觀
自然光線明亮處正視目測,應具有均勻一致的色澤,不得有明顯的色差,表面應光潔、平整,不得有變形和明顯的擦痕。
1.3 簽別
1.3.1紅外光譜
取本品適量,照包裝材料紅外光譜測定法(YBB00262004-2015)第四法測定,應與對照圖譜基本一致。
1.3.2 密度
取本品 28,加水100ml,回流2小時,放冷,80℃干2小時后,照密度測定法(YBB00132003-2015)測定,應為0.900~0.915g/cm'/0.935-0.965g/cm3
1.4 熾灼殘渣
取本品 2.08,依法檢査(中國藥典2020年版通則0841),留殘渣不得過0.1%(含迪光劑的瓶蓋熾灼殘渣不得過 3.0%)。
1.5 干燥劑含水率
1.5..硅膠
在相對濕度不超過 75%的環境中從封閉的包裝袋中迅速取出瓶蓋,并從瓶蓋中取出干劑 5-7g,置于恒重稱量瓶W,中,稱重 Wz,置于180℃+10℃烘箱中(從打開瓶蓋包裝到干燥劑放到烘箱中的總時間不得超過5分鐘)至恒重稱量為Wg,按下式計算,含水率不得超過 4.8%。
干燥劑含水率=(WzW;)/(WzW;)*100%
1.5.2 大分子篩
在相對濕度不超過 75%的環境中從封閉的包裝袋中迅速取出瓶蓋取出干燥劑置于恒重的堵渦W。(8-10g)中精密稱定 W,置于 950℃馬弗爐中(從打開瓶蓋包裝到干燥劑放到烘箱中的總時間不得超過5分鐘),烘干1小時,取出坩堝冷卻后精密稱定 W;,按照下式計算,含水率不得過 4.8%,。干燥劑含水率=(WI-Wz)/(Wi-We)*10096硅膠:大分子篩(4:6)混合物,參照大分子檢測方法檢測,技下式計算,含水率不得過過 4.8%。
干燥劑含水率=(W;-W:)/(W-Wo)*100%-A*5%
1.6 工燥劑飽和吸濕率
在相對濕度小于75%的環境中,從同一包裝袋中取5個成品蓋,精密稱定 Wo,把瓶蓋放入到溫度為 23+2℃,相對濕度為75%+5%的恒溫恒濕箱中,第8天取出稱量W小心取下紙板取出已吸湖的干燥劑;把紙板和瓶蓋擦拭干凈合并稱量 W,,按下式計算,硅膠、大分子篩、硅膠:分子篩(4:6)混合干劑的飽和吸濕率分別不得低于30%6、19%、24%
飽和吸濕率=(W,-Wo)/(WoW;)*100%
1.7干燥劑短期吸濕率
在相對濕度小于 60%的環境中,從同一包裝袋中取5個成品蓋,精密稱定Wo,把瓶蓋放入到溫度為 25+2℃,相對濕度為60%±5%的恒溫恒濕箱中,1小時后取出稱量W:小心取下紙板取出已吸潮的干燥劑;把紙板和瓶蓋擦拭干凈合并稱量w:,按下式計算,硅膠、大分子篩、硅膠:分子篩(4:6)混合干劑的飽和吸濕率分別不得超過 3%、4.5%、3.5%。
短期吸濕率=(W:-Wo)/(We-Wz)*100%
1.8 紙板含水率
在相對濕度不超過 75%的環境中,從包裝中取出瓶蓋,并從瓶中取出紙板 5-78,置于已恒重的稱量瓶(W:)中,稱重(W),置105℃+2℃烘箱中,至恒重(稱重為W;)技下式計算,含水率不得超過 6.0%。
紙板含水率=(W·W;)/(WzW)*100%
1.9 抗跌落
取瓶蓋內塞適量,置于1米處高度跌落,瓶蓋內塞不得破裂,干劑不得漏出。
1.10 紙板的理化指標
1.10.1砷
(以 AS 計)照砷鹽檢查法測定(《中國藥典》2020年版四部通則 0822第一法),含砷不得過 0.0001%.
1.10.2 鉛
以(Pb計)照原子吸收分光光度法(《中國藥典》2020年版四部通則0406測定),含鉛不得過 0.0005%。
1.10.3 熒光檢查
取紙板 100cm2,將接觸藥物面置于波長 365nm 和 254nm 紫外燈下檢査,不得有片狀熒光。
1.10.4 脫色試驗
各取紙片5片,分別加入水(60℃2℃),正已烷(25℃+2℃)50mI泡2小時,另取兩種同批次溶劑作為空白對照液,供試品液顏色不得深于空白對照。
1.11 溶出物試驗
溶出物試液的制備:分別取瓶蓋蓋體(分割成長1cm,寬1cm的小片)三份,分別置具塞錐形瓶中,加水適量,振據洗滌小片,棄去水,重復操作二次。在30~40℃干后,分別用水(70℃±2℃)、65%乙醇(70℃±2℃)、正已燒(58℃±2℃)按重盤與漫液體積(0.2g/ml)的比例浸泡24小時后,取出放冷至室溫,用同批試驗用溶劑補充至原體積即得供試液,以同批水、65%乙醇、正已烷為空白液,進行下列試驗:
1.11.1 不揮發物
分別精密量取水、65%乙醇、正已燒供試液與空白液各50ml置于已恒重的蒸發皿中,水浴蒸干,105℃干燥2小時,冷卻后精密稱定,水供試液不揮發物殘渣與其空白液殘渣之差不得過 12.0mg;65%乙醇供試液不揮發物殘渣與其空白液殘渣之差不得過50.0mg;正已烷供試液不揮發物殘渣與其空白液殘渣之差不得過 200.0mg。
1.11.2 易氧化物
精密量取水供試液 20ml,精密加入高話酸鉀滴定液(0.002mol/L)20ml與稀硫酸1ml,煮沸3分鐘,迅速冷卻,加入積化鍔0.1g,在暗處放置5分鐘,用硫代硫酸鈉滴定液(0.01mol/L)滴定,滴定至近終點時,加入淀粉指示液5滴,維續定至無色,另取水空白同法操作,二者消耗硫代硫酸鈉滴定液(0.01mo/L)之不得過 1.5ml。
1.11.3 重金屬
精密量取水供試液 20ml,加醋酸鹽緩沖液(pH3.5)2ml,依法檢查(中國藥典2020年版通則 0821第一法),含重金屬不得過百萬分之一。
1.12 微生物限度
取本品10只,在無菌環境下,將無菌棉簽用氫化鈉注射液稍微濕,擦拭瓶蓋,每只瓶蓋用兩支棉筑擦拭,每支棉簽擦拭后立即剪掉或燒斷,投入盛有10ml氯化鈉注射液的試管中,震蕩混勻,既得供試液。試液進行薄膜過濾后,依法檢查(中國藥具2020年版1105、1106),需氧苗數每個瓶蓋不得過 1000cfu,#和酵母菌每個瓶蓋不得過 100cfu,大腸埃希菌每個瓶蓋不得檢出。
1.13 異常游性*
取本品數只,將外蓋用水清洗干凈后,按重量與沒提液體積(0.2g/ml)的比例,分割成長 1cm 寬 1cm 的小片,加入氣化鈉注射液 50ml,置高壓燕汽滅菌器 110℃保持 30 分鐘后取出,冷卻,采用靜脈注射,依法檢查(中國藥典2020年版通則1141),應無異常毒性。
2 檢驗程序
2.1 規格
根據質量標準卡,在生產過程中隨機檢驗,每3小時監測一次,每次抽檢1模的數量,用游標卡尺測量主要尺寸。
2.2 外觀
自然光線明亮處正視目測,應具有均勻一致的色澤,不得有明顯的色差,表面應光潔平整,不得有變形和明顯的挨痕。
2.3 鑒別
2.3.1 紅外光譜
取本品適量,照包裝材料紅外光譜測定法(YBB00262004-2015)第四法測定,應與對照圖諧基本一致。
2.3.2密度
取本品28:加水100ml,回流2小時,放冷,80℃于2小時后,照密度測定法(YBB00132003-2015)測定,0.900~0.915g/cn*/0.935-0.965g/cm。
2.4 熾灼殘渣
取本品 2.0g,依法檢查(中國藥典2020年版通則0841),迪殘渣不得過0.1%(含光劑的瓶蓋熾灼殘渣不得過 3.0%)。
2.5 干燥劑含水率
在相對濕度不超過 75%的環境中從封閉的包裝袋中迅速取出瓶蓋,并從蓋中取出干劑 5-7g,置于恒重稱量瓶W,中,稱重 W:,置于 180℃+10℃烘箱中(從打開瓶蓋包裝到干燥劑放到烘箱中的總時間不得超過5分鐘)至恒重稱量為W,按下式計算,含水率不得超過 4.8%。
干燥劑含水率=(Wz-W;)/(Wz-W)*100%
2.6 抗跌落
取瓶蓋適量,置于1米處高度跌落,內不得與瓶蓋完全脫離、破襲,干劑不得出。
2.7干燥劑吸濕率
取試樣 1-2袋(規格 3g/袋以下取2袋,規格 3g/袋及 38/袋以上取1袋),平攤置于表面皿(或適宜容器),于150℃+5℃下干燥2小時,冷卻至室溫,快速精密稱定(m)后平置放入恒溫恒濕箱中,同法操作供制備三份樣品,三份樣品分別于溫度均為25+2℃,相對濕度分別為于20%+5%,50%+5%,90%6t5%條件下放置48小時,取出快速精密稱定(m)按下式計算:
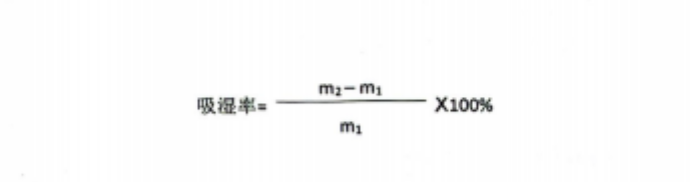
相對濕度 20%士5%條件下吸濕率不得小于7.0%,相對濕度50%土5%條件下吸濕率不得小于19.0%,相對濕度 90%士5%條件下吸濕率不得小于29.0%。
2.8 溶出物試驗
溶出物試液的制備:分別取瓶蓋蓋體(分割成長1cm,寬1cm的小片)三份,分別置具塞錐形瓶中,加水適量,振搖洗滌小片,棄去水,重復操作二次。在30~40℃干燥后,分別用水(70℃±2℃),65%乙醇(70℃±2℃),正已烷(58℃+2℃)按重量與漫提液體積(0.2g/ml)的比例漫泡 24 小時后,取出放冷至室溫,用同批試驗用溶劑補充至原體積即得供試液,以同批水、65%乙醇、正已燒為空白液,進行下列試驗:
2.8.1不揮發物
分別精密量取水、65%乙醇、正已烷供試液與空白液各 50ml置于已恒重的蒸發皿中,水浴蒸干,105℃干燥2小時,冷卻后精密稱定,水供試不揮發物殘與其空白液殘之差不得過 12.0mg;65%乙醇供試液不揮發物殘渣與其空自液殘渣之差不得過50.0mg:正已烷供試液不揮發物殘渣與其空白液殘渣之差不得過 200.0mg
2.8.2 易氧化物
精密量取水供試液 20ml,精密加入高錳酸鉀滴定液(0.002mol/L)20m1與稀酸1ml,煮沸3分鐘,迅速冷卻,加入碘化鉀0.1g,在暗處放置5分鐘,用硫代硫酸鈉滴定液(0.01mol/L)滴定,滴定至近終點時,加入淀粉指示液5滴,繼續定至無色,另取水空白液同法操作,二者消耗硫代硫酸鈉滴定液(0.01mol/L)之差不得過 1.5ml。
2.8.3 重金屬
精密量取水供試液20ml,加醋酸鹽緩沖液(pH3.5)2ml,依法檢查(中國藥典2020年版通則 0821第一法),含重金屬不得過百萬分之一。
2.9 微生物限度
取本品 10只,在無菌環境下,將無菌棉簽用化鈉注射液稍微濕,拭瓶蓋,每只瓶蓋用兩支棉簽擦拭,每支棉簽擦拭后立即剪掉或燒斷,投入盛有10m氯化銷注射液的試管中.震蕩混勻,既得供試液。試液進行薄膜過濾后,依法檢查(中國藥典2020年版 1105、1106),需氧苗數每個瓶盤不得過 1000cfu,菌和酵母菌每個瓶蓋不得過100cfu,大腸埃希菌每個瓶蓋不得檢出。
2.10 異常毒性
取本品數只,將外蓋用水清洗干凈后,按重量與浸提液體積(0.2g/ml)的比例,分成長 1cm 寬 1cm 的小片,加入氫化鈉注射液50ml,置高壓蒸汽滅菌器 110℃保持 30 分鐘后取出,冷卻,采用靜脈注射,依法檢查(中國藥典2020年版通則1141),應無異常毒性。

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃