
YBB00092002—2015
口服液體藥用高密度聚乙烯瓶
Koufuyeti Yɑoyong Gɑomidujuyixi Ping
HDPE Bottles for Oral Liquid Preparation
本標準適用于以高密度聚乙烯(HDPE)為主要原料,采用注吹成型工藝生產的口服液體制劑用塑料瓶。
【外觀】 取本品適量,在自然光線明亮處,正視目測。應具有均勻一致的色澤,不得有明顯色差。瓶的表面應光潔、平整,不得有變形和明顯的擦痕。不得有砂眼、油污、氣泡。瓶口應平整、光滑。
【鑒別】(1)紅外光譜 取本品適量,照包裝材料紅外光譜測定法(YBB00262004—2015)第四法測定,應與對照圖譜基本一致。
(2)密度 取本品 2 g,加水 100 ml,回流 2 小時,放冷,80 ℃干燥 2 小時后,照密度測定法(YBB00132003—2015)測定,應為 0.935~0.965 g/cm3。
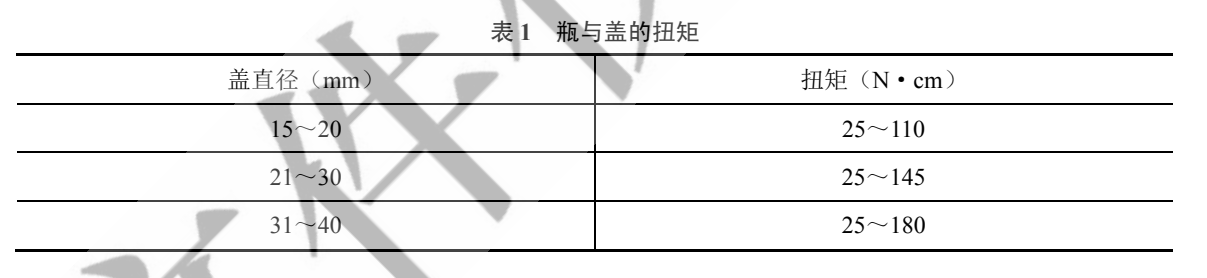
【密封性】(1)取本品適量,用測力扳手(扭矩見表 1)將瓶與蓋旋緊,瓶口與瓶蓋應配合適宜,不得滑牙。
(2)取本品適量,分別在瓶內裝入適量玻璃珠,旋緊瓶蓋(帶有螺旋蓋的試瓶用測力扳手將瓶與蓋旋緊,扭矩見表 1),置于帶抽氣裝置的容器中,用水浸沒,抽真空至真空度為 27 kPa,維持 2 分鐘,瓶內均不得有進水或冒泡現象。
表 1 瓶與蓋的扭矩
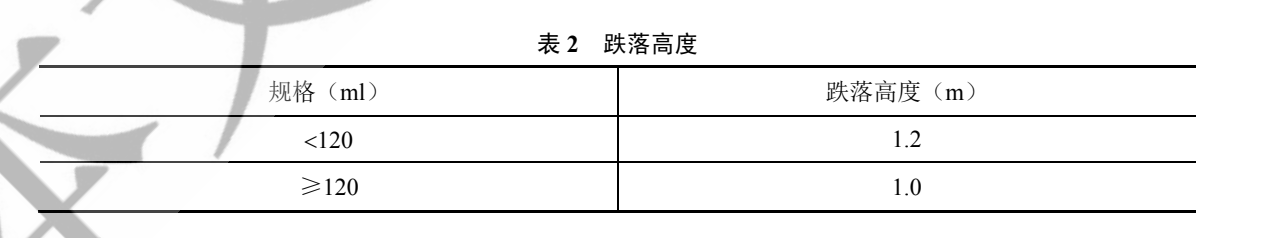
【抗跌落】 取本品適量,加入水溶液至標示容量,從規定高度(表 2)自然跌落至水平剛性光滑表面,應不得破裂。
表 2 跌落高度
【水蒸氣透過量】 取本品適量,照水蒸氣透過量測定法(YBB00092003—2015)第三法(1)在溫度 20 ℃±2 ℃,相對濕度 65%±5%的條件下,放置 14 天,重量損失不得過 0.2%。
【熾灼殘渣】 取本品 2.0 g,依法測定(《中國藥典》2015 年版四部通則 0841),遺留殘渣不得過 0.1%(含遮光劑的瓶遺留殘渣不得過 3.0%)。
【溶出物試驗】 供試液的制備:分別取本品平整部分內表面積 600 cm2(分割成長 5 cm,寬 0.3 cm 的小片)3 份,分置具塞錐形瓶中,加水適量,振搖洗滌小片,棄去水,重復操作一次。在 30~40 ℃干燥后,分別用水(70 ℃±2 ℃)、65%乙醇(70 ℃±2 ℃)、正己烷(58 ℃±2 ℃)200 ml 浸泡 24 小時后,取出放冷至室溫,用同批試驗用溶劑補充至原體積作為供試液,以同批水、65%乙醇、正己烷為空白液,進行下列試驗。
澄清度 取水供試液,依法檢查(《中國藥典》2015 年版四部通則 0902),溶液應澄清;如顯渾濁,與2 號濁度標準液比較,不得更濃。pH 變化值 取水供試液與水空白液各 20 ml,分別加入氯化鉀溶液(1→1000)1 ml,依法測定(《中國藥典》2015 年版四部通則 0631),二者 pH 值之差不得過 1.0。
吸光度 取水供試液適量,照紫外-可見分光光度法(《中國藥典》2015 年版四部通則 0401)測定,在220~360 nm 波長范圍內的最大吸收度不得過 0.10。
易氧化物 精密量取水供試液 20 ml,精密加入高錳酸鉀滴定液(0.002 mol/L)20 ml 與稀硫酸 1 ml,煮沸 3 分鐘,迅速冷卻,加入碘化鉀 0.1 g,在暗處放置 5 分鐘,用硫代硫酸鈉滴定液(0.01 mol/L)滴定,滴定至近終點時,加入淀粉指示液 5 滴,繼續滴定至無色,另取水空白液同法操作,二者消耗硫代硫酸鈉滴定液(0.01 mol/L)之差不得過 1.5 ml。
不揮發物 分別精密量取水、65%乙醇、正己烷供試液與空白液各 50 ml 置于已恒重的蒸發皿中,水浴蒸干,105 ℃干燥 2 小時,冷卻后,精密稱定,水不揮發物殘渣與其空白液殘渣之差不得過 12.0 mg;65%乙醇不揮發物殘渣與其空白液殘渣之差不得過 50.0 mg;正己烷不揮發物殘渣與其空白液殘渣之差不得過75.0 mg。
重金屬 精密量取水供試液 20 ml,加醋酸鹽緩沖液(pH 3.5)2 ml,依法測定(《中國藥典》2015 年版四部通則 0821 第一法),含重金屬不得過百萬分之一。
【脫色試驗】(著色瓶)取本品數只,截取表面積 50 cm2(以內表面計)3 份,剪成 2 cm×0.3 cm 小片,分置 3 個具塞錐形瓶中,分別加入 4%醋酸溶液(60 ℃±2 ℃),65%乙醇溶液(25 ℃±2 ℃),正己烷(25 ℃±2 ℃)50 ml 浸泡 2 小時,以同批 4%醋酸溶液、65%乙醇溶液、正己烷為空白液,浸泡液顏色不得深于空白液。
【微生物限度】 取本品數只,加入 1/2 標示容量的氯化鈉注射液,將蓋旋緊,振搖 1 分鐘,即得供試液。供試液進行薄膜過濾后,依法檢查(《中國藥典》2015 年版四部通則 1105、1106),細菌數每瓶不得過100 cfu,霉菌和酵母菌數每瓶不得過 100 cfu,大腸埃希菌每瓶不得檢出。
【異常毒性】* 將本品數只,用水清洗干凈后,取 500 cm2(以內表面積計),剪碎,加入氯化鈉注射液50 ml,置高壓蒸汽滅菌器 110 ℃保持 30 分鐘后取出,冷卻后備用,以同批無菌氯化鈉注射溶液做空白,靜脈注射,依法檢查(《中國藥典》2015 年版四部通則 1141),應符合規定。
【貯藏】 液體瓶的內包裝用藥用聚乙烯塑料袋密封,保存于干燥、清潔處。
附件 檢驗規則
1. 產品檢驗分為全項檢驗和部分檢驗。
2. 有下列情況之一時,應按標準的要求進行全項檢驗。
(1)產品注冊。
(2)產品出現重大質量事故后重新生產。
(3)監督抽驗。
(4)產品停產后重新恢復生產。
3. 產品批準注冊后,藥包材生產、使用企業在原料產地、添加劑、生產工藝等沒有變更的情形下,可按標準的要求,進行除“*”外項目檢驗。
4. 外觀、密封性、抗跌落、水蒸氣透過量、微生物限度的檢驗,按《計數抽樣檢驗程序 第 1 部分:
按接收質量限(AQL)檢索的逐批檢驗抽樣計劃》(GB/T 2828.1—2012)規定進行,檢驗項目、檢驗水平
及接收質量限見表 3。
注:1.
帶*的項目半年內至少檢驗一次。
2. 與瓶身配套的瓶蓋可根據需要選擇不同的材料,按標準中的溶出物試驗、異常毒性項目進行試驗,應符合有關項下的規定。
原文下載:![]() 口服液體藥用高密度聚乙烯瓶.pdf
口服液體藥用高密度聚乙烯瓶.pdf

 冀公網安備 13010802000997號
冀公網安備 13010802000997號 微信掃一掃
微信掃一掃